Effects of quercetin on the viability of pulmonary epithelial cell and the expression of epithelial mesenchymal transition markers induced by paraquat
-
摘要:目的 探讨槲皮素(Que)对百草枯(PQ)处理肺上皮细胞(MLE-12)的存活率和上皮间质转化(epithelial-mesenchymal transition,EMT)的影响及机制。方法 采用CCK-8法分别检测不同剂量PQ(50、150、450 μmol/L)对MLE-12细胞存活率的影响。实验设立空白对照组、阳性对照组、PQ(150 μmol/L)+Que(30、60、90μmol/L)干预组、阴性对照组,在Que干预24 h后检测细胞存活率。应用荧光定量PCR法和蛋白免疫印迹(Western blot)法分别检测α-SMA、结缔组织生长因子(connective tissue growth factor,CTGF)、E-Cadherin、TGF-β1、Smad3、Akt、mTOR的mRNA和蛋白表达。结果 经PQ(150 μmol/L)处理后,60 μmol/L和90 μmol/L的Que能够显著提高MLE-12细胞存活率,与阳性对照组比较差异有统计学意义(P < 0.05)。荧光定量PCR法和Western blot法检测结果表明,与空白对照组比较,50 μmol/L的PQ能提高α-SMA、CTGF、E-Cadherin、TGF-β1、Smad3、Akt、mTOR的mRNA表达,以及α-SMA、CTGF、E-Cadherin、TGF-β1、Smad3、Akt的蛋白表达(P < 0.05);150 μmol/L的PQ能提高TGF-β1和mTOR的mRNA表达,以及α-SMA、E-Cadherin、TGF-β1、Smad3的蛋白表达(P < 0.05);450 μmol/L的PQ能提高CTGF和Smad3的mRNA表达,以及α-SMA、E-Cadherin、Smad3的蛋白表达(P < 0.05)。在不同浓度Que干预PQ(150 μmol/L)染毒的MLE-12细胞后,与阳性对照组相比,30 μmol/L的Que能降低α-SMA、TGF-β1、Akt、mTOR的mRNA和蛋白表达水平,以及α-SMA、CTGF、Akt、mTOR的蛋白表达水平(P < 0.05);60 μmol/L的Que能提高CTGF、E-Cadherin、Smad3、Akt的mRNA表达水平,以及α-SMA、Smad3、mTOR的蛋白表达水平(P < 0.05);90 μmol/L的Que能降低TGF-β1、mTOR的mRNA表达水平,提高CTGF的mRNA表达水平,降低Akt、mTOR的蛋白表达水平(P < 0.05)。结论 百草枯染毒可能通过TGF-β1诱导细胞发生上皮间质转化。槲皮素干预能提高百草枯染毒MLE-12细胞的存活率,并能改变细胞上皮间质转化程度,其机制可能是通过调控TGF-β1/Smad和Akt/mTOR信号通路实现。
-
百草枯(paraquat,PQ)广泛运用于农牧业生产,其引发的中毒事故时有发生。临床研究数据表明,百草枯中毒病人在后期多会发生肺纤维化[1]。如何早期预防百草枯致肺纤维化或逆转纤维化成了目前学界研究的重点。目前,研究肺纤维化的机制主要集中在氧化损伤学说、炎症学说和上皮间质转化(epithelial-mesenchymal transition,EMT)学说。转化生长因子-β1(transforming growth factor beta 1,TGF-β1)是致纤维化的关键细胞因子,它可促进细胞过度增殖、分化,继而诱导α-平滑肌肌动蛋白(alpha-smooth muscle actin,α-SMA)和结缔组织生长因子(connective tissue growth factor,CTGF)的表达增加,刺激细胞外基质(extracellular matrix,ECM)在肺泡间和肺间质过度积聚,从而导致肺纤维化[2-3]。
目前国内外多以糖皮质激素和免疫抑制剂作为治疗肺纤维化的主要手段,虽为经典用药,但长期大剂量服用副作用大,且对有基础疾病(如糖尿病、高血压)患者的应用存在限制[4]。因此,针对肺纤维化的药物研究一直是临床的研究热点。
槲皮素(quercetin,Que)分子式C15H10O7,是黄酮类物质的主要成分,来源广泛,具有抗氧化[5]、抗炎[6]、抗感染[7]及抗肿瘤[8]等多种生物活性作用。有研究发现,槲皮素能改善肾脏纤维化,减轻肾脏损伤,说明槲皮素在防治肺纤维化方面具有较大的潜力[5],但是目前有关槲皮素减轻百草枯所致肺损伤的研究鲜有报道。另外,已有多项研究表明,在肺纤维化发生发展过程中,TGF-β1/Smad和TGF-β1介导的Akt/mTOR信号通路是肺纤维化形成的重要调控通路[9],结合槲皮素的抗炎抗氧化的作用,有必要进一步探讨槲皮素抗肺纤维化的可能性。因此,本研究旨在探讨在百草枯染毒肺上皮细胞后,观察EMT相关蛋白表达情况,以及槲皮素干预后细胞的存活率和TGF-β1介导相关信号通路表达的变化情况,从而探讨槲皮素对百草枯致肺纤维化的保护机制,为防治百草枯致肺纤维化提供理论依据。
1. 材料与方法
1.1 材料
1.1.1 细胞与试剂
小鼠肺上皮细胞MLE-12(中国广州优迪生物科技股份有限公司);百草枯(Sigma,美国);Quercetin(Sigma,美国);外源TGF-β1(Sigma,美国);CCK-8试剂盒(DoJinDo,日本);SYBR Premix EX Taq ⅡKit(Takara,中国);Prime ScriptTMRT reagent Kit(Takara,中国);组织细胞总蛋白抽提试剂盒(中国北京普利莱基因技术有限公司);Akt抗体(武汉博士德生物工程有限公司);mTOR抗体(SANTA,美国);E-Cadherin抗体(CST,美国);TGF-β1抗体、Smad3抗体、GAPDH抗体,均购自美国Abcam公司;α-SMA抗体(Bs-10196R)、CTGF抗体(Bs-0743R),均购自北京博奥森生物技术有限公司;二抗goat anti-rabbit IgG(H + L)HRP(南京巴傲得生物科技有限公司);PageRuler Prestained Protein Ladder(Thermo Fisher Scientific,美国);超敏ECL化学发光即用型底物(武汉博士德生物工程有限公司);还原型SDS -PAGE 5 × Loading Buffer(北京康为世纪生物科技有限公司)。
1.1.2 仪器
ABI 7300荧光定量仪(Thermo Fisher Scientific,美国),Bio-rad C1000 PCR仪(Thermal Cycler,美国),ABI 3900台式高通量DNA合成仪(Thermo Fisher Scientific,美国),AF100制冰机(Scotsman,美国),Scanspeed 1730R低温离心机(Labogene,丹麦),QL-901微型振荡器(中国海门市麒麟医用仪器厂),Bio-rad Mini型电泳、电转系统(Thermal Cycler,美国),LG 2000数码凝胶图像分析系统(中国杭州朗基科学仪器有限公司),AX-Ⅱ X射线摄影暗匣(中国广东粤华医疗器械厂有限公司),JXFSTPRP-24全自动样品快速研磨仪(中国上海净信实业发展有限公司),RT-6000自动酶标仪(中国深圳雷杜生命科学股份有限公司)。
1.2 方法
1.2.1 细胞培养
MLE-12细胞培养于含体积分数10%胎牛血清的DMEM培养基中,加入体积分数1%的青霉素和链霉素双抗,放置37 ℃,体积分数5%CO2条件下进行培养,待细胞融合至80%,用含体积分数0.25%胰蛋白酶消化,每4 ~ 5 d按1∶3比例传代,取对数生长期细胞进行后续实验。
1.2.2 CCK-8增殖实验
取对数生长期细胞,配制细胞悬液,以每孔5 × 103个/L细胞的密度接种于96孔板中,置于37 ℃、体积分数5%CO2培养箱中培养24 h,待贴壁后,进行不同浓度药物处理,设置空白对照组,每组设3个平行复孔。每孔加入10 μL CCK-8溶液,放培养箱孵育2 h,用酶标仪测定450 nm处的吸光度(A)值。
1.2.3 实验分组及干预
为探讨不同剂量PQ染毒对MLE-12细胞的影响,实验设立空白对照组、TGF-β1(5 ng/mL)阳性对照组、PQ(50、150、450 μmol/L)组;根据CCK-8实验结果,选择对细胞活性无明显影响的PQ剂量和Que剂量范围,实验设立空白对照组、阳性对照组、PQ + Que(30、60、90 μmol/L)干预组、阴性对照组Que(60 μmol/L),Que干预时间为24 h。
1.2.4 荧光定量PCR
细胞使用Trizol裂解液处理后,提取总RNA,用凝胶成像系统观察RNA抽提的完整性。取4 μL RNA模板做逆转录反应,取2 μL模板cDNA在20 μL反应体系中进行PCR反应。根据每个反应的Ct值,以β-actin作为参照基因,使用2-△△Ct标准方法计算表达水平。扩增目的基因正向和反向引物序列如下。Akt:Forward:5’-CTTCTCTGTGGCGCAGTGC-3’,Reverse:5’-ACATGGAAGGTGCGTTCGAT-3’;m-TOR:Forward:5’-TTCTGTGGCTGTGAGGTCTGA-3’,Reverse:5’-GCCTTCTGCCTCTTATGGGC-3’;E-Cadherin:Forward:5’-TGCAGTTGAGGATCCAATGG-3’,Reverse:5’-TGAATTCGGGCTTGTTGTCA-3’;α-SMA:Forward:5’-ACTTCGGGTAAACCAAAAACCA-3’,Reverse:5’-TGTCCCCAACTTTCCACTGTT-3’;CTGF:Forward:5’-GGAAGAGAACATTAAGAAGGGCAAA-3’,Reverse:5’-TGCTGGTGCAGCCAGAAAG-3’;TGF-β1:Forward:5’-CAAGGGCAGCTGTCAGAACA-3’,Reverse:5’-GGCAAATTACCACTCGGAAGTT-3’;Smad3:Forward:5’-TCGAGCCCCAGAGCAATATT-3’,Reverse:5’-TGGAGAACCTGCGTCCATG-3’;β-actin:Forward:5’-GCATGGGTCAGAAGGATTCCT -3’,Reverse:5’-TCGTCCCAGTTGGTGACGAT -3’。
1.2.5 免疫印迹(Western blot)
MLE-12细胞经过PQ或Que处理后,按比例加入裂解液充分裂解后,12 000 g向心力离心3 ~ 5 min,取上清,提取总蛋白后,立即按照BCA蛋白测定法(bicinchoninic acid protein assay,BCA)测定蛋白浓度。制作SDS-PAGE胶,电泳分离蛋白,转膜(Akt、Smad3用300 mA,60 min;mTOR用300 mA,120 min;E-Cadherin用300 mA,90 min;α-SMA、CTGF、TGF-β1用300 mA,40min),质量分数5%的脱脂奶粉的封闭液室温封闭2 h,孵育一抗,用TBST稀释(Akt、mTOR,1∶400;TGF β1、E-Cadherin、CTGF,1∶1 000;α-SMA,1∶10 000;Smad3,1∶2 000;内参GAPDH,1∶10 000),4 ℃孵育过夜,洗膜,孵育二抗,用TBST稀释(1∶40 000),室温孵育2 h,用ECL显色试剂盒显色,洗片进行显影和定影,拍照记录和半定量分析。结合内参GAPDH计算各蛋白相对表达水平,结果以积分光密度(IOD)描述。
1.2.6 统计学分析
采用GraphPad Prism 8软件进行统计学分析和作图。计量资料以均数±标准差(x ± s)表示。多组组间均数比较采用方差分析,各实验组与空白对照组和阳性对照组均数的进一步比较采用Tukey’s multiple comparisons test。检验水准α = 0.05(双侧)。
2. 结果
2.1 不同浓度PQ和Que对MLE-12细胞存活率的影响
分别应用不同浓度PQ染毒和Que给药处理MLE-12细胞24 h,使用CCK-8法检测各组细胞的存活率。结果发现,不同浓度(50、150、250、350、450 μmol/L)PQ能降低MLE-12细胞存活率,但各浓度组及空白对照组细胞存活率差异无统计学意义(P > 0.05);不同浓度(10、30、60、90、120 μmol/L)Que能降低MLE-12细胞存活率,但各浓度组及空白对照组细胞存活率差异无统计学意义(P > 0.05),见表 1、表 2。
表 1 不同浓度PQ对MLE-12细胞存活率的影响(n = 3)浓度/(μmol/L) 存活率/% 空白 100 50 100.00 ± 0.00 150 92.33 ± 16.92 250 76.00 ± 14.53 350 91.67 ± 16.50 450 82.00 ± 28.79 F值 1.054 P值 0.432 表 2 不同浓度Que对MLE-12细胞存活率的影响(n = 3)浓度/(μmol/L) 存活率/% 空白 100 10 100.00 ± 0.00 30 90.33 ± 28.31 60 97.33 ± 35.22 90 90.00 ± 22.61 120 86.00 ± 21.70 F值 0.215 P值 0.952 2.2 MLE-12细胞在PQ染毒后的EMT和相关信号通路基因mRNA和蛋白表达情况
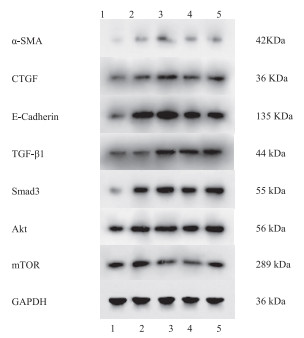
MLE-12细胞在不同浓度的PQ染毒后,检测α-SMA、CTGF、E-Cadherin、TGF-β1、Smad3、Akt、mTOR的mRNA和蛋白表达。结果发现,不同浓度的PQ能不同程度地提高各基因的mRNA和蛋白表达,见表 3、表 4和图 1。与空白对照组比较,低浓度PQ(50 μmol/L)提高了各基因的mRNA的相对表达水平,以及除了mTOR蛋白外其余6种蛋白的相对表达水平,差异均有统计学意义(P < 0.05)。中浓度PQ(150 μmol/L)可以提高TGF-β1和mTOR mRNA的相对表达水平,以及α-SMA、E-Cadherin、TGF-β1、Smad3的蛋白相对表达水平(P < 0.05)。高浓度PQ(450 μmol/L)能显著提高CTGF和Smad3的mRNA的相对表达水平,以及α-SMA、E-Cadherin、Smad3的蛋白相对表达水平(P < 0.05)。
表 3 不同浓度PQ处理MLE-12细胞后,各组mRNA相对表达水平(n = 3)组别 CTGF α-SMA E-Cadherin TGF-β1 Smad3 Akt mTOR 空白对照组 0.94 ± 0.16 1.07 ± 0.22 0.75 ± 0.26 1.00 ± 0.01 0.78 ± 0.19 0.79 ± 0.28 1.15 ± 0.50 TGF-β1(5 ng/mL) 2.54 ± 0.51 1.71 ± 0.14 2.32 ± 0.43① 1.69 ± 0.50 1.51 ± 0.37 1.45 ± 0.27 4.36 ± 1.02① PQ(50 μmol/L) 6.39 ± 1.16①② 5.45 ± 1.78①③ 2.21 ± 0.29① 5.33 ± 1.02①② 4.06 ± 0.75①② 2.81 ± 0.54①② 5.95 ± 1.37① PQ(150 μmol/L) 2.17 ± 0.50③ 2.27 ± 0.31③ 1.04 ± 0.11②③ 3.40 ± 0.81①②③ 1.61 ± 0.26③ 1.04 ± 0.20③ 8.65 ± 1.58①② PQ(450 μmol/L) 2.91 ± 0.46①③ 2.02 ± 0.53③ 1.47 ± 0.52 1.37 ± 0.18③ 3.86 ± 1.10①② 1.46 ± 0.34③ 2.49 ± 0.93③ F值 29.952 12.101 11.707 24.492 16.767 15.184 19.966 P值 < 0.001 < 0.001 < 0.001 < 0.001 < 0.001 < 0.001 < 0.001 注:①与空白对照组比较,P < 0.05;②与TGF-β1(5 ng/mL)组比较,P < 0.05;③与低剂量组PQ(50 μmol/L)比较,P < 0.05。 表 4 不同浓度PQ处理MLE-12细胞后,各组蛋白相对表达水平比较(IOD值,n = 3)组别 α-SMA CTGF E-Cadherin TGF-β1 Smad3 Akt mTOR 空白对照组 0.06 ± 0.02 0.21 ± 0.06 0.19 ± 0.04 0.11 ± 0.03 0.29 ± 0.06 0.55 ± 0.07 0.45 ± 0.07 TGF-β1(5 ng/mL) 0.17 ± 0.03① 0.32 ± 0.04 0.46 ± 0.06① 0.16 ± 0.03 0.52 ± 0.05① 0.81 ± 0.09 0.68 ± 0.06① PQ(50 μmol/L) 0.32 ± 0.05①② 0.38 ± 0.05① 0.48 ± 0.06① 0.32 ± 0.04①② 0.79 ± 0.05①② 0.99 ± 0.12① 0.59 ± 0.04③ PQ(150 μmol/L) 0.24 ± 0.05① 0.32 ± 0.04 0.36 ± 0.04①③ 0.28 ± 0.04①② 0.60 ± 0.04①③ 0.72 ± 0.14 0.40 ± 0.05② PQ(450 μmol/L) 0.22 ± 0.02①③ 0.31 ± 0.02 0.40 ± 0.03① 0.19 ± 0.03③ 0.75 ± 0.04①② 0.79 ± 0.08 0.52 ± 0.04② F值 21.390 6.004 18.854 18.973 44.513 7.136 12.503 P值 < 0.001 0.010 < 0.001 < 0.001 < 0.001 0.006 < 0.001 注:①与空白对照组比较,P < 0.05;②与TGF-β1(5 ng/mL)组比较,P < 0.05;③与低剂量组PQ(50 μmol/L)比较,P < 0.05。 2.3 Que对PQ染毒后MLE-12细胞存活率的影响
以不同浓度Que干预经PQ(150 μmol/L)染毒后的MLE-12细胞24 h后,使用CCK-8法检测各组细胞存活率。结果发现,60 μmol/L和90 μmol/L浓度的Que能够提高MLE-12细胞存活率,与阳性对照组存活率比较差异有统计学意义(P < 0.05)。见表 5。
表 5 以不同浓度Que干预PQ(150 μmol/L)染毒MLE-12细胞的存活率比较(n = 3) 组别 存活率/% 空白对照组 100 PQ 77.29 ± 12.32 Que(30 μmol/L)+ PQ 88.74 ± 13.57 Que(60 μmol/L)+ PQ 130.83 ± 20.54① Que(90 μmol/L)+ PQ 174.61 ± 13.88①②③ Que(60μmol/L) 144.13 ± 29.20①③ F值 13.743 P值 < 0.001 注:①与空白对照组比较,P < 0.05;②与低剂量干预组Que(30 μmol/L)+ PQ比较,P < 0.05;③与阳性对照组PQ(150 μmol/L)比较,P < 0.05。 2.4 Que对PQ染毒MLE-12细胞干预后的EMT和相关信号通路基因mRNA和蛋白表达情况
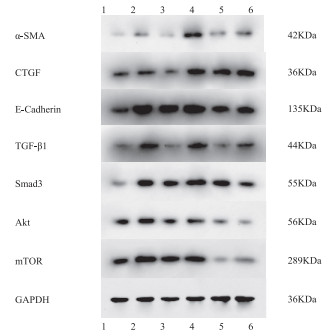
不同浓度的Que干预PQ(150 μmol/L)染毒MLE-12细胞后,检测α-SMA、CTGF、E-Cadherin、TGF-β1、Smad3、Akt、mTOR的mRNA和蛋白表达,见表 6、表 7和图 2。结果发现,与阳性对照组相比,低浓度Que(30 μmol/L)能降低PQ染毒后α-SMA、TGF-β1、Akt、mTOR的mRNA表达水平,以及α-SMA、CTGF、Akt、mTOR的蛋白的相对表达水平,差异均有统计学意义(P < 0.05)。中浓度Que(60 μmol/L)能提高PQ染毒后CTGF、E-Cadherin、Smad3、Akt的mRNA表达水平,以及α-SMA、Smad3、mTOR蛋白的相对表达水平,差异具有统计学意义(P < 0.05)。高浓度Que(90 μmol/L)能降低PQ染毒后TGF-β1、mTOR的mRNA表达水平,提高CTGF的mRNA表达水平,降低Akt、mTOR蛋白的相对表达水平,差异具有统计学意义(P < 0.05)。
表 6 不同浓度Que干预PQ(150 μmol/L)染毒MLE-12细胞后,各组基因mRNA相对表达水平(n = 3)组别 α-SMA CTGF E-Cadherin TGF-β1 Smad3 Akt mTOR 空白对照组 1.03 ± 0.05 0.99 ± 0.19 0.94 ± 0.16 0.99 ± 0.21 0.90 ± 0.09 1.01 ± 0.26 0.93 ± 0.14 PQ 2.76 ± 0.33① 2.35 ± 0.17 1.58 ± 0.14 3.57 ± 0.19① 2.25 ± 0.43 1.55 ± 0.13 7.21 ± 1.23① Que(30 μmol/L)+ PQ 0.68 ± 0.14② 1.89 ± 0.29 1.75 ± 0.44 1.07 ± 0.05② 1.74 ± 0.36 0.86 ± 0.35② 2.14 ± 0.19② Que(60 μmol/L)+ PQ 2.93 ± 0.93①③ 7.56 ± 0.42①②③ 2.90 ± 0.77①②③ 5.05 ± 0.80①②③ 7.14 ± 2.47①②③ 2.62 ± 0.26①②③ 7.48 ± 1.66①③ Que(90 μmol/L)+ PQ 2.14 ± 0.26③ 4.90 ± 1.19①②③ 1.20 ± 0.10 1.12 ± 0.17② 4.21 ± 0.95① 0.99 ± 0.057 0.26 ± 0.05② Que(60μmol/L) 1.30 ± 0.23② 6.26 ± 1.34①②③ 1.32 ± 0.15 1.86 ± 0.29② 2.05 ± 0.27 1.13 ± 0.20 2.53 ± 0.66② F值 14.344 35.490 9.9612 60.895 12.712 25.516 37.268 P值 < 0.001 < 0.001 < 0.001 < 0.001 < 0.001 < 0.001 < 0.001 注:①与空白对照组比较,P < 0.05;②与阳性对照组PQ(150 μmol/L)比较,P < 0.05;③与低剂量干预组Que(30 μmol/SL)+ PQ比较,P < 0.05。 表 7 不同浓度Que干预PQ(150 μmol/L)染毒MLE-12细胞后,各组蛋白相对表达水平比较(IOD值,n = 3)组别 α-SMA CTGF E-Cadherin TGF-β1 Smad3 Akt mTOR 空白对照组 0.09 ± 0.02 0.24 ± 0.02 0.19 ± 0.04 0.12 ± 0.06 0.27 ± 0.03 0.53 ± 0.05 0.43 ± 0.08 PQ 0.26 ± 0.02① 0.32 ± 0.02 0.32 ± 0.03① 0.28 ± 0.06 0.61 ± 0.11① 0.70 ± 0.05① 1.10 ± 0.12① Que(30 μmol/L)+ PQ 0.10 ± 0.02② 0.23 ± 0.02② 0.35 ± 0.04① 0.12 ± 0.06 0.43 ± 0.08 0.39 ± 0.02①② 0.63 ± 0.10② Que(60 μmol/L)+ PQ 0.38 ± 0.05①②③ 0.40 ± 0.03①③ 0.38 ± 0.03① 0.33 ± 0.07①③ 0.94 ± 0.14①②③ 0.64 ± 0.04③ 0.84 ± 0.07①② Que(90 μmol/L)+ PQ 0.22 ± 0.02①③ 0.32 ± 0.02③ 0.24 ± 0.02③ 0.13 ± 0.05 0.71 ± 0.10①③ 0.31 ± 0.03①② 0.18 ± 0.07①②③ Que(60μmol/L) 0.33 ± 0.02①③ 0.40 ± 0.06①③ 0.28 ± 0.02① 0.21 ± 0.06 0.38 ± 0.08 0.19 ± 0.04①②③ 0.36 ± 0.03②③ F值 49.820 15.624 16.923 7.0592 19.381 74.525 47.078 P值 < 0.001 < 0.001 < 0.001 0.003 < 0.001 < 0.001 < 0.001 注:①与空白对照组比较,P < 0.05;②与阳性对照组PQ(150μmol/L)比较,P < 0.05;③与低剂量干预组Que(30 μmol/L)+ PQ比较,P < 0.05。 3. 讨论
百草枯(PQ)中毒对人体的健康和生活质量产生严重影响,其导致的肺损伤和肺纤维化目前还没有有效的治疗方法。肺纤维化早期的病变基础是急性肺泡炎,在肺泡炎形成过程中涉及细胞因子、炎症细胞和自由基等。细胞因子可促进肺成纤维细胞过度增殖、分化,继而促进胶原蛋白等ECM在肺间质和肺泡间过度积聚,导致肺纤维化的发生与发展。目前发现的对肺纤维化有一定治疗效果的中药主要集中在:抑制炎症因子的释放,发挥抗炎症损伤作用;影响胶原代谢过程,从而减少胶原蛋白的形成;抗自由基损伤,影响机体免疫功能,降低应激反应强度等方面[10]。有前期研究表明,槲皮素纳米脂质载体可降低PQ诱导的人淋巴细胞死亡和活性氧(reactive oxygen species,ROS)生成,具有治疗和预防PQ中毒的潜在价值[11]。另有研究[12]发现,槲皮素能缓解不对称二甲基精氨酸诱导的肾脏纤维化,为探讨Que防治肺纤维化提供了可能。
本研究结果显示,PQ在50 ~ 450 μmol/L浓度上对MLE-12细胞的存活率影响较小,各浓度Que能够剂量依赖提高PQ染毒的MLE-12细胞存活率,提示Que能够缓解PQ的毒性作用并刺激MLE-12细胞的生长。采用对细胞影响较小的低浓度PQ和Que进行实验,有利于模拟人体内低剂量PQ致肺纤维化效应。
研究显示,上皮间充质转化(EMT)参与了PQ诱导肺纤维化的进程[13]。α-SMA、CTGF、E-Cadherin蛋白是发生EMT时的标志蛋白。α-SMA是成纤维细胞活化的标志,其表达引起成纤维细胞向肌成纤维细胞的转变[14]。CTGF作为一种促纤维化因子,可通过与表皮生长因子受体结合,调节成纤维细胞ECM的合成和诱导上皮细胞的EMT产生[15]。E-Cadherin参与形成细胞间黏附性连接,当E-Cadherin下调时,会造成细胞间极性减弱,黏附性减少,促进细胞的迁移活动[16]。本研究发现,不同浓度PQ均能不同程度地提高MLE-12细胞α-SMA、CTGF、E-Cadherin的mRNA及蛋白质的表达(表 3和表 4)。低浓度PQ在转录水平和翻译水平上均显著提高细胞内EMT标志蛋白的表达,而中高浓度PQ主要影响α-SMA、E-Cadherin在翻译水平上的表达。经Que干预结果显示,低浓度Que能降低α-SMA和CTGF的表达,中高浓度Que却提高CTGF和E-Cadherin的表达(表 6和表 7)。实验结果说明在PQ诱导下,MLE-12细胞出现EMT趋势,而Que可能通过抑制α-SMA的表达延缓EMT进程。
本研究发现MLE-12细胞对不同浓度物质作用的敏感性不同,细胞的EMT效应和Que的干预效果没有呈现剂量-效应关系,这可能是由于PQ染毒的时间较短和染毒的浓度较低,导致未能产生稳定的EMT效应。为更好地观察PQ致EMT效应和Que的干预效果,后续实验将延长PQ处理时间,在稳定细胞EMT的趋势后,作进一步验证。
TGF-β1是致纤维化关键性的细胞因子,导致肺纤维化的发生与发展。有多项研究指出可通过调节TGF-β1/Smad信号通路,抑制细胞EMT标志物的表达和迁移[17-19],从而减轻PQ诱导的肺纤维化。Akt/mTOR信号通路也是TGF-β介导肺纤维化的重要通路。国外研究表明,Akt1可能是治疗肺纤维化的新靶点,使用Akt抑制剂triciribine可改善TGF-β诱导的肺纤维化[20]。另外,Akt通过氨基酸末端的PH结构域磷酸化激活mTOR参与肺纤维化的过程。国内报道中,1,25-(OH)2D3通过降低博来霉素诱导肺纤维化小鼠模型中的Ⅱ型肺泡上皮细胞上的Ca2+浓度,从而抑制Akt/mTOR通路,达到抗肺纤维化的目的[21]。本研究结果可知,PQ能不同程度地提高TGF-β1、Smad3、Akt、mTOR的表达水平,与PQ诱导的EMT标志蛋白表达趋势较一致,得到的结果也是低浓度PQ的作用效果较中高浓度PQ的作用显著(表 3和表 4)。经Que干预后发现,低浓度Que和高浓度Que能降低TGF-β1、Akt、mTOR的表达,同时细胞EMT的程度减轻;中浓度Que干预后却发现EMT程度增加,Smad3、Akt、mTOR表达也增加(表 6和表 7)。干预结果一方面提示了Que能通过TGF-β1/Smad和Akt/mTOR信号通路调控EMT的进程;另一方面提示了Que具有能够多环节、多靶点地作用于细胞的复杂特性[8],因此不同干预浓度的Que可能对细胞的EMT产生不同的作用,需进一步验证。
综上所述,PQ染毒可能通过TGF-β1诱导MLE-12细胞发生上皮间质转化;Que(60 μmol/L和90 μmol/L)能增加PQ染毒MLE-12细胞存活率,并能改变上皮间质转化标志物的表达,其机制可能是对TGF-β1/Smad和Akt/mTOR信号通路的调控来发挥作用的。
作者声明 本文无实际或潜在的利益冲突 -
表 1 不同浓度PQ对MLE-12细胞存活率的影响(n = 3)
浓度/(μmol/L) 存活率/% 空白 100 50 100.00 ± 0.00 150 92.33 ± 16.92 250 76.00 ± 14.53 350 91.67 ± 16.50 450 82.00 ± 28.79 F值 1.054 P值 0.432 表 2 不同浓度Que对MLE-12细胞存活率的影响(n = 3)
浓度/(μmol/L) 存活率/% 空白 100 10 100.00 ± 0.00 30 90.33 ± 28.31 60 97.33 ± 35.22 90 90.00 ± 22.61 120 86.00 ± 21.70 F值 0.215 P值 0.952 表 3 不同浓度PQ处理MLE-12细胞后,各组mRNA相对表达水平(n = 3)
组别 CTGF α-SMA E-Cadherin TGF-β1 Smad3 Akt mTOR 空白对照组 0.94 ± 0.16 1.07 ± 0.22 0.75 ± 0.26 1.00 ± 0.01 0.78 ± 0.19 0.79 ± 0.28 1.15 ± 0.50 TGF-β1(5 ng/mL) 2.54 ± 0.51 1.71 ± 0.14 2.32 ± 0.43① 1.69 ± 0.50 1.51 ± 0.37 1.45 ± 0.27 4.36 ± 1.02① PQ(50 μmol/L) 6.39 ± 1.16①② 5.45 ± 1.78①③ 2.21 ± 0.29① 5.33 ± 1.02①② 4.06 ± 0.75①② 2.81 ± 0.54①② 5.95 ± 1.37① PQ(150 μmol/L) 2.17 ± 0.50③ 2.27 ± 0.31③ 1.04 ± 0.11②③ 3.40 ± 0.81①②③ 1.61 ± 0.26③ 1.04 ± 0.20③ 8.65 ± 1.58①② PQ(450 μmol/L) 2.91 ± 0.46①③ 2.02 ± 0.53③ 1.47 ± 0.52 1.37 ± 0.18③ 3.86 ± 1.10①② 1.46 ± 0.34③ 2.49 ± 0.93③ F值 29.952 12.101 11.707 24.492 16.767 15.184 19.966 P值 < 0.001 < 0.001 < 0.001 < 0.001 < 0.001 < 0.001 < 0.001 注:①与空白对照组比较,P < 0.05;②与TGF-β1(5 ng/mL)组比较,P < 0.05;③与低剂量组PQ(50 μmol/L)比较,P < 0.05。 表 4 不同浓度PQ处理MLE-12细胞后,各组蛋白相对表达水平比较(IOD值,n = 3)
组别 α-SMA CTGF E-Cadherin TGF-β1 Smad3 Akt mTOR 空白对照组 0.06 ± 0.02 0.21 ± 0.06 0.19 ± 0.04 0.11 ± 0.03 0.29 ± 0.06 0.55 ± 0.07 0.45 ± 0.07 TGF-β1(5 ng/mL) 0.17 ± 0.03① 0.32 ± 0.04 0.46 ± 0.06① 0.16 ± 0.03 0.52 ± 0.05① 0.81 ± 0.09 0.68 ± 0.06① PQ(50 μmol/L) 0.32 ± 0.05①② 0.38 ± 0.05① 0.48 ± 0.06① 0.32 ± 0.04①② 0.79 ± 0.05①② 0.99 ± 0.12① 0.59 ± 0.04③ PQ(150 μmol/L) 0.24 ± 0.05① 0.32 ± 0.04 0.36 ± 0.04①③ 0.28 ± 0.04①② 0.60 ± 0.04①③ 0.72 ± 0.14 0.40 ± 0.05② PQ(450 μmol/L) 0.22 ± 0.02①③ 0.31 ± 0.02 0.40 ± 0.03① 0.19 ± 0.03③ 0.75 ± 0.04①② 0.79 ± 0.08 0.52 ± 0.04② F值 21.390 6.004 18.854 18.973 44.513 7.136 12.503 P值 < 0.001 0.010 < 0.001 < 0.001 < 0.001 0.006 < 0.001 注:①与空白对照组比较,P < 0.05;②与TGF-β1(5 ng/mL)组比较,P < 0.05;③与低剂量组PQ(50 μmol/L)比较,P < 0.05。 表 5 以不同浓度Que干预PQ(150 μmol/L)染毒MLE-12细胞的存活率比较
(n = 3) 组别 存活率/% 空白对照组 100 PQ 77.29 ± 12.32 Que(30 μmol/L)+ PQ 88.74 ± 13.57 Que(60 μmol/L)+ PQ 130.83 ± 20.54① Que(90 μmol/L)+ PQ 174.61 ± 13.88①②③ Que(60μmol/L) 144.13 ± 29.20①③ F值 13.743 P值 < 0.001 注:①与空白对照组比较,P < 0.05;②与低剂量干预组Que(30 μmol/L)+ PQ比较,P < 0.05;③与阳性对照组PQ(150 μmol/L)比较,P < 0.05。 表 6 不同浓度Que干预PQ(150 μmol/L)染毒MLE-12细胞后,各组基因mRNA相对表达水平(n = 3)
组别 α-SMA CTGF E-Cadherin TGF-β1 Smad3 Akt mTOR 空白对照组 1.03 ± 0.05 0.99 ± 0.19 0.94 ± 0.16 0.99 ± 0.21 0.90 ± 0.09 1.01 ± 0.26 0.93 ± 0.14 PQ 2.76 ± 0.33① 2.35 ± 0.17 1.58 ± 0.14 3.57 ± 0.19① 2.25 ± 0.43 1.55 ± 0.13 7.21 ± 1.23① Que(30 μmol/L)+ PQ 0.68 ± 0.14② 1.89 ± 0.29 1.75 ± 0.44 1.07 ± 0.05② 1.74 ± 0.36 0.86 ± 0.35② 2.14 ± 0.19② Que(60 μmol/L)+ PQ 2.93 ± 0.93①③ 7.56 ± 0.42①②③ 2.90 ± 0.77①②③ 5.05 ± 0.80①②③ 7.14 ± 2.47①②③ 2.62 ± 0.26①②③ 7.48 ± 1.66①③ Que(90 μmol/L)+ PQ 2.14 ± 0.26③ 4.90 ± 1.19①②③ 1.20 ± 0.10 1.12 ± 0.17② 4.21 ± 0.95① 0.99 ± 0.057 0.26 ± 0.05② Que(60μmol/L) 1.30 ± 0.23② 6.26 ± 1.34①②③ 1.32 ± 0.15 1.86 ± 0.29② 2.05 ± 0.27 1.13 ± 0.20 2.53 ± 0.66② F值 14.344 35.490 9.9612 60.895 12.712 25.516 37.268 P值 < 0.001 < 0.001 < 0.001 < 0.001 < 0.001 < 0.001 < 0.001 注:①与空白对照组比较,P < 0.05;②与阳性对照组PQ(150 μmol/L)比较,P < 0.05;③与低剂量干预组Que(30 μmol/SL)+ PQ比较,P < 0.05。 表 7 不同浓度Que干预PQ(150 μmol/L)染毒MLE-12细胞后,各组蛋白相对表达水平比较(IOD值,n = 3)
组别 α-SMA CTGF E-Cadherin TGF-β1 Smad3 Akt mTOR 空白对照组 0.09 ± 0.02 0.24 ± 0.02 0.19 ± 0.04 0.12 ± 0.06 0.27 ± 0.03 0.53 ± 0.05 0.43 ± 0.08 PQ 0.26 ± 0.02① 0.32 ± 0.02 0.32 ± 0.03① 0.28 ± 0.06 0.61 ± 0.11① 0.70 ± 0.05① 1.10 ± 0.12① Que(30 μmol/L)+ PQ 0.10 ± 0.02② 0.23 ± 0.02② 0.35 ± 0.04① 0.12 ± 0.06 0.43 ± 0.08 0.39 ± 0.02①② 0.63 ± 0.10② Que(60 μmol/L)+ PQ 0.38 ± 0.05①②③ 0.40 ± 0.03①③ 0.38 ± 0.03① 0.33 ± 0.07①③ 0.94 ± 0.14①②③ 0.64 ± 0.04③ 0.84 ± 0.07①② Que(90 μmol/L)+ PQ 0.22 ± 0.02①③ 0.32 ± 0.02③ 0.24 ± 0.02③ 0.13 ± 0.05 0.71 ± 0.10①③ 0.31 ± 0.03①② 0.18 ± 0.07①②③ Que(60μmol/L) 0.33 ± 0.02①③ 0.40 ± 0.06①③ 0.28 ± 0.02① 0.21 ± 0.06 0.38 ± 0.08 0.19 ± 0.04①②③ 0.36 ± 0.03②③ F值 49.820 15.624 16.923 7.0592 19.381 74.525 47.078 P值 < 0.001 < 0.001 < 0.001 0.003 < 0.001 < 0.001 < 0.001 注:①与空白对照组比较,P < 0.05;②与阳性对照组PQ(150μmol/L)比较,P < 0.05;③与低剂量干预组Que(30 μmol/L)+ PQ比较,P < 0.05。 -
[1] ELENGA N, MERLIN C, REMI LE GUERN, et al. Clinical features and prognosis of paraquat poisoning in French Guiana: a review of 62 cases[J]. Medicine, 2018, 97(15): e9621. doi: 10.1097/MD.0000000000009621
[2] ISHIDA Y, TAKAYASU T, KIMURA A, et al. Gene expression of cytokines and growth factors in the lungs after paraquat administration in mice[J]. Legal Med, 2006, 8(2): 102-109. doi: 10.1016/j.legalmed.2005.08.010
[3] TOYGAR M, AYDIN I, AGILLI M, et al. The relation between oxidative stress, inflammation, and neopterin in the paraquat-induced lung toxicity[J]. Hum Exp Toxicol, 2015, 34(2): 198-204. doi: 10.1177/0960327114533808
[4] LORENZEN J M, SCHONENBERGER E, HAFER C, et al. Failed rescue therapy with rapamycin after paraquat intoxication[J]. Clin Toxicol, 2010, 48(1): 84-86. doi: 10.3109/15563650903376089
[5] ZERIN T, KIM Y S, HONG S Y, et al. Quercetin reduces oxidative damage induced by paraquat via modulating expression of antioxidant genes in A549 cells[J]. J Appl Toxicol, 2013, 33(12): 1460-1467. doi: 10.1002/jat.2812
[6] AMIN M, PUTRA K S, AMIN I F, et al. Quercetin: the bioactive compound from Allium cepa L. as anti-inflammation based on in silico screening[J]. Bio Med Natur Prod Chem, 2018, 7(1): 27-31. doi: 10.14421/biomedich.2018.71.27-31
[7] SUN D, LI N, ZHANG W, et al. Quercetin-loaded PLGA nanoparticles: a highly effective antibacterial agent in vitro and anti-infection application in vivo[J]. J Nanopart Res, 2016, 18(1): 3. doi: 10.1007/s11051-015-3310-0
[8] 王刚, 杜士明, 杨光义, 等. 槲皮素抗肿瘤的分子机制研究进展[J]. 中国医院药学杂志, 2011, 31(4): 322-324. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGYZ201104024.htm [9] ZHANG L, LI Y, LIANG C, et al. CCN5 overexpression inhibits profibrotic phenotypes via the PI3K/Akt signaling pathway in lung fibroblasts isolated from patients with idiopathic pulmonary fibrosis and in an in vivo model of lung fibrosis[J]. Int J Mol Med, 2014, 33(2): 478-486. doi: 10.3892/ijmm.2013.1565
[10] 俞新, 杨继兵. 肺纤维化中医药研究进展[J]. 中华现代中医学杂志, 2010, 6(1): 14-16. https://www.cnki.com.cn/Article/CJFDTOTAL-SXXY201302053.htm [11] AHMADIAN E, EFTEKHARI A, KAVETSKYY T, et al. Effects of quercetin loaded nanostructured lipid carriers on the paraquat-induced toxicity in human lymphocytes[J]. Pestic Biochem Physiol, 2020, 167: 104586. doi: 10.1016/j.pestbp.2020.104586
[12] GUO W, DING J, ZHANG A, et al. The inhibitory effect of quercetin on asymmetric dimethylarginine-induced apoptosis is mediated by the endoplasmic reticulum stress pathway in glomerular endothelial cells[J]. Int J Mol Sci, 2014, 15(1): 484-503. doi: 10.3390/ijms15010484
[13] ZHU Y, TAN J, XIE H, et al. HIF-1 regulates EMT via the Snail and β-catenin pathways in paraquat poisoning-induced early pulmonary fibrosis[J]. J Cell Mol Med, 2016, 20(4): 688-697. doi: 10.1111/jcmm.12769
[14] STEWART G A, HOYNE G F, AHMAD S A, et al. Expression of the developmental sonic hedgehog (Shh) signalling pathway is up-regulated in chronic lung fibrosis and the Shh receptor patched 1 is present in circulating T lymphocytes[J]. J Pathol, 2003, 199(4): 488-495. doi: 10.1002/path.1295
[15] LING J, TAN K, LU L, et al. lncRNA MIAT increases cell viability, migration, EMT and ECM production in age-related cataracts by regulating the miR181a/CTGF/ERK signaling pathway[J]. Exp Ther Med, 2020, 20(2): 1053-1063. doi: 10.3892/etm.2020.8749
[16] GAO F, ZHANG Y, YANG Z, et al. Arctigenin suppressed epithelial-mesenchymal transition through Wnt3a/β-catenin pathway in PQ-induced pulmonary fibrosis[J]. Front Pharmacol, 2020, 11: 584098. doi: 10.3389/fphar.2020.584098
[17] BAI Y W, YE M J, YANG D L, et al. Hydrogen sulfide attenuates paraquat-induced epithelial-mesenchymal transition of human alveolar epithelial cells through regulating transforming growth factor-β1/Smad2/3 signaling pathway[J]. J Appl Toxicol, 2019, 39(3): 432-440. doi: 10.1002/jat.3734
[18] HUA X F, LI X H, LI M M, et al. Doxycycline attenuates paraquat-induced pulmonary fibrosis by downregulating the TGF-β signaling pathway[J]. J Thorac Dis, 2017, 9(11): 4376-4386. doi: 10.21037/jtd.2017.10.42
[19] TYAGI N, SINGH D K, DASH D, et al. Curcumin modulates paraquat-induced epithelial to mesenchymal transition by regulating transforming growth factor-β (tgf-β) in A549 cells[J]. Inflammation, 2019, 42(4): 1441-1455. doi: 10.1007/s10753-019-01006-0
[20] ABDALLA M, SABBINENI H, PRAKASH R, et al. The Akt inhibitor, triciribine, ameliorates chronic hypoxia-induced vascular pruning and TGFβ-induced pulmonary fibrosis[J]. Br J Pharmacol, 2015, 172(16): 4173-4188. doi: 10.1111/bph.13203
[21] 董洪亮, 刘乃国, 苗双, 等. 1, 25-(OH)2D3对肺纤维化大鼠中PI3K、AKT、mTOR表达的影响及其机制研究[J]. 中国现代医学杂志, 2018, 28(19): 1-6. doi: 10.3969/j.issn.1005-8982.2018.19.001 -
期刊类型引用(1)
1. 李显,侯晓,张麟征,晏飞,常淑凡,王卓文,陈洋,王威. 发电企业职业病危害因素与防护策略探讨. 中国职业医学. 2023(02): 235-241 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载: