A meta-analysis of a case-control study of asbestos exposure and renal cell carcinoma in workplaces
-
+ English摘要:目的 探究职业接触石棉与患肾癌风险的关系。方法 检索有关职业接触石棉与患肾癌的电子文献数据库(中国知网、维普、万方、PubMed、EBSCO、Elsevier Science direct、Medical、Cochrane Library),根据Newcastle-Ottawa scale(NOS)量表评价纳入文献的质量,对评价低于6分的文献不予纳入。用STATA12.0软件对文献的OR值及其95%置信区间进行合并。通过I2及P值对合并后的数据进行异质性检验。使用敏感性分析判定结果的稳定性,并做亚组分析。结果 共检索到文献248篇,最终纳入8篇文章、10个病例-对照研究,病例组3 725例,对照组6 970例。10项研究之间存在较低的异质性(I2 < 0.1%,P = 0.585)。合并的效应值表明工作场所接触石棉会增加患肾癌的风险(OR = 1.30,95% CI:1.17 ~ 1.45,P < 0.01)。敏感性分析和亚组分析均证实了本次结果较稳定,并且未见明显的发表偏倚。结论 工作场所接触石棉会增加患肾癌的风险。
-
肾细胞癌(renal-cell carcinoma,RCC)是起源于肾实质泌尿小管上皮系统的恶性肿瘤。RCC是肾脏最常见的癌症,发病率很高(约占所有确诊癌症的7%),且在过去几十年里,发病率一直在上升,尤其是在工业化国家[1]。尽管有针对RCC的各种流行病学研究,但其病因在很大程度上仍不清楚。石棉导致的肺癌、间皮瘤已被确认,然而对于石棉导致的肾癌研究结果却不尽相同[2]。Mandel等[3]的病例-对照研究分别纳入1 732名病例、2 039名对照,结果显示接触石棉人群中患肾癌的风险增加了40%(OR = 1.40,95%CI:1.10 ~ 1.80)。Mattioli等[4]的研究发现在控制了吸烟、饮酒、饮食等因素后,石棉与肾癌依旧存在正相关关系(OR = 7.11,95%CI:1.46 ~ 34.51)。1994—1997年加拿大的一项调查[5]显示接触石棉与患肾癌具有正相关性(OR=1.40,95% CI∶1.01 ~ 1.40),但Parent等[6]在1979—1985年间的研究显示石棉与患肾癌无相关性。Pesch等[7]的研究显示男性接触石棉会导致肾癌(OR = 1.30,95%CI:1.00 ~ 1.70),女性则不会(OR = 1.50,95%CI:0.8 ~ 2.80)。此外,肾脏的不同位置对于石棉的敏感性也不同,McCredie等[8]发现肾细胞癌与石棉有相关性,肾盂癌则不然。有些研究[9-10]则显示肾癌与接触石棉无关。最近的一个meta分析[11]通过标准化死亡率(standardized mortality ratio,SMR)对接触石棉和患肾癌的关系进行了分析,结果显示职业接触石棉可导致患肾癌的风险增加10%,但是纳入的很多研究的病例不是原始病例且样本量较少,有些病例是死亡病例,通过标准化死亡率计算石棉与肾癌的关系对结果的可靠性有一定的影响。
因此,本研究拟扩大研究样本,选择病例-对照研究对接触石棉工人的肾癌患病情况进行荟萃分析,研究两者的关联性,以提供更明确的证据。
1. 资料与方法
1.1 文献检索策略
检索中国知网、维普、万方、PubMed、EBSCO、Elsevier Science direct、Medical、Cochrane Library等学术文献电子数据库,中文数据库以“石棉”and“肾癌”“肾细胞癌”为主题词,英文数据库以“asbestos” and “kidney cance”(or “tumor” or “carcinoma” or “neoplasm” or “malignancy” or “renal-cell carcinoma”)为主题词进行检索。同时查阅相关文献综述,收集国内外有关接触石棉与患肾癌的文献作为参考。检索时限为建库至2021年9月。由2名检索员独立检索文献,通过浏览文献题目、摘要,必要时阅读全文以确定是否纳入,再将文献的题目、作者、发表年份、研究人群来源、控制的混杂因素及统计值等信息录入。若同一篇研究文献中将性别进行单独统计,则视为两个独立的研究。
1.2 文献纳入和排除标准
纳入标准:(1)研究类型为病例-对照研究;(2)病例组为职业活动中接触石棉粉尘,且调查的对象在调查时是存活的肾癌患者,对照组为从研究区域的人口登记中随机选择的存活的非肾癌患者;(3)所得结果控制了混杂因素;(4)文献质量评价评分≥ 6分。满足以下条件之一即排除:(1)摘要、评论或综述性文章;(2)设计或分析方法存在明显缺陷;(3)研究结局是死亡病例;(4)未提供OR值及95%可信区间;(5)接触-无接触的队列研究。
1.3 文献质量评价
病例-对照研究评分根据纽卡斯尔-渥太华量表(The Newcastle-Ottawa Scale,NOS)[12]制定的三部分8条标准评价文献的质量,量表满分9分。即研究人群选择、组间可比性、暴露因素的测量,分别包含4个、1个和3个条目,每个条目有不同的评价标准,若满足则计为1分即1颗星(仅组间有可比性的1个条目计2分)。以条目1 “病例确定是否恰当(1分)”为例,其评价标准包括3种:(1)恰当,有独立的确定方法或人员;(2)恰当,如基于档案记录或自我报告;(3)未描述。若文献为(1)的情况,则该条目得分为1颗星,反之不得分。文献得分≥ 6分即可认为是高质量文献。
1.4 统计学分析
应用Stata 12.0软件进行统计学分析,在数据提取时,统一选择该研究中对最高暴露组和最低暴露组人群进行比较、同时校正混杂因素最全的一个模型。对纳入的文献进行异质性分析,通过I2及相应P值进行异质性判断,当I2≤ 50.0%且P > 0.10时,可认为多个同类研究具有同质性,采用固定效应模型分析;当I2 > 50.0%且P ≤ 0.10时,认为多个研究结果存在异质性,用随机效应模型分析。若异质性过大(> 80%)则放弃研究。若存在可接受的异质性,则根据混杂因素、性别、样本量等因素进行亚组分析,或通过排除1篇文章后重新计算统计量进行敏感性分析来探索异质性来源。采用漏斗图法检验发表偏倚。
2. 结果
2.1 文献检索结果
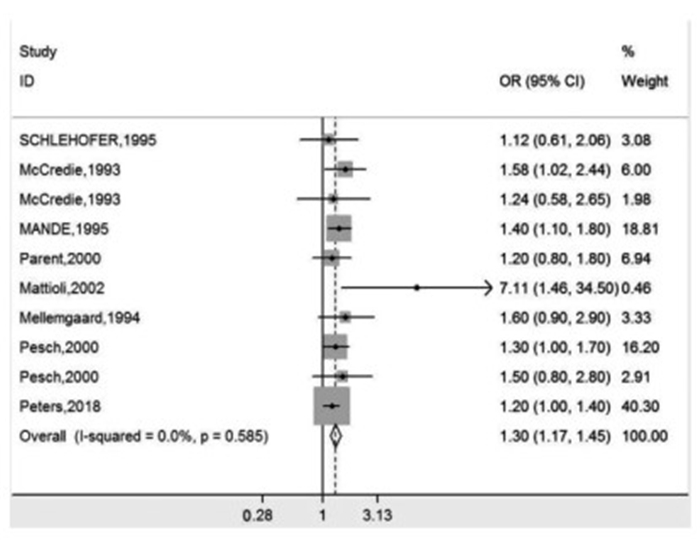
共检索到文献248篇(其中中国知网67篇,万方9篇,Pubmed 96篇,EBSCO 56篇,Elsevier Science direct 20篇),未搜到相关中文文献。剔除重复文献、综述性文献、非相关研究文献、动物实验、不满足纳入标准等研究文献,最后纳入文献8篇[3-10]10个病例-对照研究。文献筛选过程见图 1。纳入的10个研究结果的具体情况、质量评分见表 1。
表 1 纳入文献一般特征作者 发表年份 病例组 对照组 地区 调查期间 OR(95%CI值) 校正混杂 文章质量 McCredie [8] 1993 RCC:489 523 New South Wales 1989—1990 RCC:1.58
(1.02 ~ 2.44)年龄,性别,访问方式,教育 8 McCredie [8] 1993 RPC:147 523 New South Wales 1989—1990 RPC:1.24
(0.58 ~ 2.65)年龄,性别,访问方式,教育 8 Schlehofer [9] 1995 277 286 Germany 1989—1991 RCC男:1.12
(0.61 ~ 2.05)年龄,吸烟,参考标准暴露小于5年 8 Mandel [3] 1995 1 732 2 039 Australia/Berlin/Heidelberg/Sweden/Denmark/USA 1989—1991 RCC男:1.40
(1.10 ~ 1.80)年龄,地区,体质量指数,吸烟,教育 8 Parent [6] 2000 142 553 Canada 1979—1985 RCC男:1.20
(0.80 ~ 1.80)访问方式,年龄,吸烟,体质量指数,职业混杂 7 Mellemgaard [10] 1994 368 396 Denmark 1989—1992 RCC男:1.60
(0.90 ~ 2.90)年龄,体质量指数,吸烟 6 Pesch [7] 2000 RCC男:103 2 650男 Germany 1991—1992 RCC男:1.30
(1.00 ~ 1.70)年龄,吸烟 8 Pesch [7] 2000 RCC女:15 1 648女 Germany 1991—1992 RCC女:1.50
(0.8 ~ 2.80)年龄,吸烟 8 Peters [5] 2018 712 2 454 Canada 1994—1997 RCC男:1.20
(1.00 ~ 1.40)年龄,地区,体质量指数,吸烟,教育 7 Mattioli [4] 2002 219 219 Italy 1987—1994 RCC男:7.11
(1.46 ~ 34.51)年龄,性别,体质量指数,吸烟,咖啡,饮酒,药物,肉类 8 注:McCredie[8]是同一个研究中的肾癌的不同组的数据;Mandel [3],Mellemgaard[10]研究中只调查了男性;Pesch[7]根据英国的工作暴露矩阵(job-exposure matrix)选择数据。 2.2 meta分析结果
对纳入研究的10个研究进行meta分析,合计病例组3 725例,对照组6 970例,研究之间存在较低的异质性(I2 < 0.1%,P = 0.585),因此采用固定效应模型对职业接触石棉工人中肾癌的患病情况结果进行合并meta分析,OR合并 = 1.30(95%CI:1.17 ~ 1.45,P < 0.01),提示职业性接触石棉工人中患肾癌的风险是未接触人群的1.30倍。见图 2。
2.3 敏感性分析
为了分析哪些因素可能影响研究结局,方便精确排除混杂因素,对文献进一步做敏感性分析。采用每次排除1个研究结果的方法,对纳入的10个研究结果逐个排除进行分析。当一个研究被移除后,剩余研究的总的OR值和95%CI值的区间为1.28(95%CI:1.14 ~ 1.44)~ 1.37(95%CI:1.20 ~ 1.58),结果显示此次meta分析的结果稳定性较好。
2.4 亚组分析
依据肾癌类型、性别、发表时间、样本量、地理位置、调整的混杂因素进行亚组分析,除了女性石棉接触者(n = 1)、肾癌类型为肾盂癌(renal pelvis cancer,RPC)(n = 1)外,其他分层分析均显示接触石棉会导致肾癌。见表 2。
表 2 接触石棉与患肾癌的亚组分析亚组分析 研究数 OR值 95%CI值 P值 I2值/% 肾癌类型 RCC 9 1.30 1.17 ~ 1.45 0.485 < 0.1 RPC 1 1.24 0.58 ~ 2.65 - - 样本例数 > 1 000 5 1.30 1.15 ~ 1.46 0.702 < 0.1 < 1 000 5 1.33 1.07 ~ 1.74 0.259 24.3 地理位置 北半球 7 1.26 1.11 ~ 1.43 0.411 1.9 南半球 3 1.43 1.16 ~ 1.75 0.834 < 0.1 性别 男 9 1.28 1.14 ~ 1.43 0.375 6.9 女 1 1.5 0.80 ~ 2.82 - - 发表时间 2000年前 5 1.41 1.17 ~ 1.70 0.894 < 0.1 2000年后 5 1.25 1.10 ~ 1.43 0.256 24.8 调整吸烟因素 是 8 1.29 1.15 ~ 1.44 0.463 < 0.1 否 2 1.49 1.02 ~ 2.17 0.588 < 0.1 2.5 发表偏倚
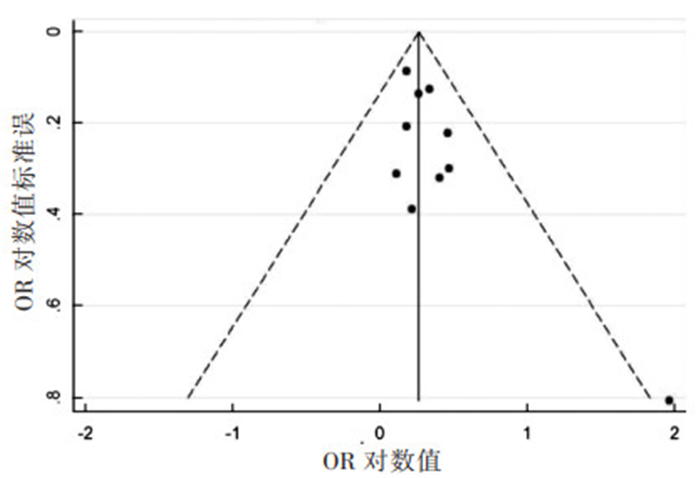
无论Egger’s直线回归法(P = 0.057)还是Begg’s等级相关测试(P = 0.371)都提供了不具有统计学意义的结果,说明不存在发表偏倚。Begg’s等级相关测试所得漏斗图见图 4。
3. 讨论
早在20世纪90年代中期,一项多中心病例-照研究对肾癌进行了大规模的研究,其中包含了石棉暴露的相关信息。据统计,经常接触石棉的工人患肾癌的概率增加了40% [3],此外,动物实验已证明暴露于石棉的小鼠和大鼠肾脏中存在石棉沉积物[13]。在人体尸检研究中,已在几个非呼吸和非消化器官中发现石棉,其中包括肾脏[14],此研究证明接触石棉可能会增加罹患肾癌的风险。国外有研究[11]对石棉和肾癌关系进行了meta分析,但对研究类型没有进行限制,且在纳入的研究中包含了死亡病例,使用标化死亡率(standardized mortality ratio,SMR)指标进行效果评价,且未对可能与肾癌发生有关的混杂因素(吸烟、年龄等因素)进行控制,因此可能降低因果推断的效力。
石棉是已知的致癌物质,其引起的癌症以肺癌[15]和间皮瘤[16]多见,其机制尚不清晰,以往的研究认为石棉致癌机制之一是由于损伤错配修复基因DNA引起的[17],此外接触石棉后可导致抑癌基因P16/CDKN2A失活[18],也会引起p53基因和活性氧自由基的异常表达[19]。张燕等[20]发现B淋巴细胞瘤-2基因(Bcl-2)与肿瘤发生发展有关,Bcl-xL蛋白和Bcl-2的作用途径相似。应用Bcl-xL反义核酸转染间瘤细胞,显示Bcl-xL与Bcl-2的表达均显著降低,同时对化疗药物敏感性也明显提高[21],这些机制都可能导致癌症的发生。肾脏并不通过吸入直接接触石棉,但从肺部清除的石棉可能会转移到肾脏,在那里纤维有机会与组织相互作用并启动癌变[22]。已有研究证实石棉会引起不与石棉直接接触的卵巢癌[23]。
20世纪80年代前后,发达国家已经逐步限制石棉的使用,同时为降低石棉所致疾病做了大量工作,比如采取湿式作业及寻找石棉替代品等措施来降低石棉粉尘的暴露浓度,以减少相关疾病的发生[24]。而我国对职业接触石棉引起的健康危害的研究很少。一项接触石棉拆船工人的队列研究显示,男性工人癌症总发病率升高,其中肺癌的发病率升高最为明显[25]。2008—2012年我国间皮瘤的年龄标化发病率为1.51/100万,但其真实发病率有可能因漏报而被低估[26]。2013年,我国新增恶性间皮瘤病例2 041例,标准人口年龄标化发病率估算为1.03/100万。有研究[27]发现,接触石棉的生产工人恶性胸膜间皮瘤的标化发病率明显增加。由于石棉的危害逐步被认识但其所致的肾癌极其少见,本研究在国内首次利用循证医学分析方法研究石棉与肾癌之间的关联,meta分析的结果显示OR合并 = 1.30(95%CI:1.17 ~ 1.45),表明职业性石棉暴露可能导致患肾癌的风险增加30%。考虑到吸烟、年龄等因素与肾癌发生有密切关联,因此本研究进一步做了分层研究,结果显示除女性、RPC类型肾癌患者(都仅一份研究)与接触石棉未见明显关系外,其他因素均显示接触石棉可能增加患肾癌的风险。
本次研究结果为了减少异质性的来源,纳入的文献均是病例-对照研究,且仅考虑了存活的研究对象。由于研究样本多来自医院或社区,暴露资料可能存在回忆偏倚,故因果论证关系还需要加强。肾癌发生的病因较复杂,除了控制吸烟、年龄等混杂因素外,还应考虑作业场所存在的其他可能的致癌因素对其发病的影响。总之,虽然本研究文献筛选严格,但可能还有其他影响因素没有被考虑到。今后需要更多以职业人群为基础的大样本量病例-对照或巢式病例-对照研究,以及队列研究去验证石棉与患肾癌的关系。在职业病防治工作中,我们一方面需要关注职业病危害因素导致的职业病,另一方面要对职业场所存在的危害因素进行识别和监测,更应教会职业人群如何做好个人防护。
作者声明 本文无实际或潜在的利益冲突 -
表 1 纳入文献一般特征
作者 发表年份 病例组 对照组 地区 调查期间 OR(95%CI值) 校正混杂 文章质量 McCredie [8] 1993 RCC:489 523 New South Wales 1989—1990 RCC:1.58
(1.02 ~ 2.44)年龄,性别,访问方式,教育 8 McCredie [8] 1993 RPC:147 523 New South Wales 1989—1990 RPC:1.24
(0.58 ~ 2.65)年龄,性别,访问方式,教育 8 Schlehofer [9] 1995 277 286 Germany 1989—1991 RCC男:1.12
(0.61 ~ 2.05)年龄,吸烟,参考标准暴露小于5年 8 Mandel [3] 1995 1 732 2 039 Australia/Berlin/Heidelberg/Sweden/Denmark/USA 1989—1991 RCC男:1.40
(1.10 ~ 1.80)年龄,地区,体质量指数,吸烟,教育 8 Parent [6] 2000 142 553 Canada 1979—1985 RCC男:1.20
(0.80 ~ 1.80)访问方式,年龄,吸烟,体质量指数,职业混杂 7 Mellemgaard [10] 1994 368 396 Denmark 1989—1992 RCC男:1.60
(0.90 ~ 2.90)年龄,体质量指数,吸烟 6 Pesch [7] 2000 RCC男:103 2 650男 Germany 1991—1992 RCC男:1.30
(1.00 ~ 1.70)年龄,吸烟 8 Pesch [7] 2000 RCC女:15 1 648女 Germany 1991—1992 RCC女:1.50
(0.8 ~ 2.80)年龄,吸烟 8 Peters [5] 2018 712 2 454 Canada 1994—1997 RCC男:1.20
(1.00 ~ 1.40)年龄,地区,体质量指数,吸烟,教育 7 Mattioli [4] 2002 219 219 Italy 1987—1994 RCC男:7.11
(1.46 ~ 34.51)年龄,性别,体质量指数,吸烟,咖啡,饮酒,药物,肉类 8 注:McCredie[8]是同一个研究中的肾癌的不同组的数据;Mandel [3],Mellemgaard[10]研究中只调查了男性;Pesch[7]根据英国的工作暴露矩阵(job-exposure matrix)选择数据。 表 2 接触石棉与患肾癌的亚组分析
亚组分析 研究数 OR值 95%CI值 P值 I2值/% 肾癌类型 RCC 9 1.30 1.17 ~ 1.45 0.485 < 0.1 RPC 1 1.24 0.58 ~ 2.65 - - 样本例数 > 1 000 5 1.30 1.15 ~ 1.46 0.702 < 0.1 < 1 000 5 1.33 1.07 ~ 1.74 0.259 24.3 地理位置 北半球 7 1.26 1.11 ~ 1.43 0.411 1.9 南半球 3 1.43 1.16 ~ 1.75 0.834 < 0.1 性别 男 9 1.28 1.14 ~ 1.43 0.375 6.9 女 1 1.5 0.80 ~ 2.82 - - 发表时间 2000年前 5 1.41 1.17 ~ 1.70 0.894 < 0.1 2000年后 5 1.25 1.10 ~ 1.43 0.256 24.8 调整吸烟因素 是 8 1.29 1.15 ~ 1.44 0.463 < 0.1 否 2 1.49 1.02 ~ 2.17 0.588 < 0.1 -
[1] WUNDERLICH H, SCHUMANN S, JANTITZKY V, et al. Increase of renal cell carcinoma incidence in central Europe[J]. Eur Urol, 1998, 33(6): 538-541. doi: 10.1159/000019652
[2] SMITH A H, SHEARN V I, WOOD R. Asbestos and kidney cancer: the evidence supports a causal association[J]. Am J Ind Med, 1989, 16(2): 159-166. doi: 10.1002/ajim.4700160207
[3] MANDEL J S, McLAUGHLIN J K, SCHLEHOFER B, et al. International renal-cell cancer study, Ⅳ, Occupation[J]. Int J Cancer, 1995, 61(5): 601-605. doi: 10.1002/ijc.2910610503
[4] MATTIOLI S, TRUFFELLI D, BALDASSERONI A, et al. Occupational risk factors for renal cell carcinoma: a case-control study in northern Italy[J]. J Occup Environ Med, 2002, 44(11): 1028-1036. doi: 10.1097/00043764-200211000-00009
[5] PETERS C E, PARENT M E, HARRIS S A, et al. Workplace exposure to asbestos and the risk of kidney cancer in Canadian men[J]. Can J of Public Health, 2018, 109(4): 464-472. doi: 10.17269/s41997-018-0095-9
[6] PARENT M E, HUA Y, SIEMIATYCKI J. Occupational risk factors for renal cell carcinoma in Montreal[J]. Am J Ind Med, 2000, 38(6): 609-618. doi: 10.1002/1097-0274(200012)38:6<609::AID-AJIM1>3.0.CO;2-4
[7] PESCH B, HAERTING J, RANFT U, et al. Occupational risk factors for renal cell carcinoma: agent-specific results from a case-control study in Germany. MURC Study Group. Multicenter urothelial and renal cancer study[J]. Int J Epidemiol, 2000, 29(6): 1014-1024. doi: 10.1093/ije/29.6.1014
[8] MCCREDIE M, STEWART J H. Risk factors for kidney cancer in New South Wales Ⅳ. Occupation[J]. Br J Ind Med, 1993, 50(4): 349-354.
[9] SCHLEHOFER B, HEUER C, BLETTNER M, et al. Occupation, smoking and demographic factors, and renal cell carcinoma in Germany[J]. Int J Epidemiol, 1995, 24(1): 51-57. doi: 10.1093/ije/24.1.51
[10] MELLEMGAARD A, ENGHOLM G, McLAUGHLIN J K, et al. Occupational risk factors for renal cell carcinoma in Denmark[J]. Scand J Environ Med, 1994, 20(3): 160-165.
[11] SALI D, BOFFETTA P. Kidney cancer and occupational exposure to asbestos: a meta-analysis of occupational cohort studies[J]. Cancer Causes Control, 2000, 11(1): 37-47. doi: 10.1023/A:1008905302597
[12] STANG A. Critical evaluation of the Newcastle-Ottawa scale for the assessment of the quality of non-randomized studies in meta-analyses[J]. Eur J Epidemiol, 2010, 25: 603-605. doi: 10.1007/s10654-010-9491-z
[13] KANAZAWA K, BIRBECK M S, CARTER R L, et al. Migration of asbestos fibers from subcutaneous injection sites in mice[J]. Br J Cancer, 1970, 24(1): 96-106. doi: 10.1038/bjc.1970.13
[14] LANGER A M. Inorganic particles in human tissues and their association with neoplastic disease[J]. Environ Health Perspect, 1974, 9: 229-233. doi: 10.1289/ehp.749229
[15] LANDRIGAN P J. The third wave of asbestos disease: exposure to asbestos in place. Public health control. Introduction[J]. Ann N Y Acad Sci, 1991, 643: xv-xvi. doi: 10.1111/j.1749-6632.1991.tb24438.x
[16] SEIDMAN H, SELIKOFF I J, HAMMOND E C. Short-term asbestos work exposure and long-term observation[J]. Ann N Y Acad Sci, 1979, 330: 61-89. doi: 10.1111/j.1749-6632.1979.tb18710.x
[17] HIRAKU Y, KAWANISHI S, ICHINOSE T, et al. The role of iNOS-mediated DNA damage in infection and asbestos-induced carcinogenesis[J]. Ann N Y Acad Sci, 2010(1203): 15-22.
[18] ANDUJAR P, WANG J, DESCATHA A, et al. pl6INK4A inactivation mechanisms in non-small cell lung cancer patients occupationally exposed to asbestos[J]. Lung Cancer, 2010, 67(1): 23-30. doi: 10.1016/j.lungcan.2009.03.018
[19] KAMP D W. Asbestos-induced lung diseases: an update[J]. Transl Res, 2009, 153(4): 143-152. doi: 10.1016/j.trsl.2009.01.004
[20] 张燕, 孙雅红, 徐从高. 凋亡抑制因子与肿瘤耐药研究进展[J]. 国际肿瘤学杂志, 2006, 33(7): 500-502. doi: 10.3760/cma.j.issn.1673-422X.2006.07.007 [21] HOPKINS-DONALDSON S, CATHOMAS R, SIMOES-WUST A P, et al. Induction of apoptosis and chemosensitization of mesothelioma cells by Bcl-2 and Bcl-xL antisense treatment[J]. Int J Cancer, 2003, 106(2): 160-166. doi: 10.1002/ijc.11209
[22] CHOI H S, ASHITATE Y, LEE J H, et al. Rapid translocation of nanoparticles from the lung airspaces to the body[J]. Nat Biotechnol, 2010, 28(12): 1300-1303. doi: 10.1038/nbt.1696
[23] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Wood dust: a review of human carcinogens: arsenic, metals, fibres, and dusts[A]. World Health Organization, International Agency for Research on Cancer, France, 2012.
[24] 张幸. 石棉相关癌症防控的紧迫性不容忽视[J]. 中华劳动卫生职业病杂志, 2021, 39(2): 81-84. [25] WU W T, LIN Y J, SHIUE H S, et al. Cancer incidence of Taiwanese ship breaking workers who have been potentially exposed to asbestos[J]. Environ Res, 2014(132): 370-378.
[26] MAO W, ZHANG X, GUO Z, et al. Association of asbestos exposure with malignant mesothelioma incidence in eastern China[J]. JAMA Oncol, 2017, 3(4): 562-564. doi: 10.1001/jamaoncol.2016.5487
[27] LIN C K, CHANG Y Y, WANG J D, et al. Increased standardised incidence ratio of malignant pleural mesothelioma in Taiwanese asbestos workers: a 29-year retrospective cohort study[J]. Biomed Res lnt, 2015: 678598.






 下载:
下载: