Determination of four amide compounds in urine by liquid-liquid extraction gas chromatography
-
摘要:目的 建立同时测定尿中N,N-二甲基甲酰胺(N,N-dimethylformamide,DMF)、N,N-二甲基乙酰胺(N,N- dimethylacetamide,DMAC)、N-甲基甲酰胺(N-methylformamide,NMF)和N-甲基乙酰胺(N-methylacetamide,NMAC)的液液萃取-气相色谱法。方法 取10.0 mL尿样,加入3.6 g NaCl溶解,再加入2.0 mL异丁醇进行涡旋萃取,经毛细管柱HP-Innowax(30 m × 0.32 mm × 0.50 μm)分离,氮磷检测器检测。结果 4种待测物浓度在0.20 ~ 50.0 μg/mL范围内线性关系良好,相关系数r在0.999 5 ~ 0.999 9之间。检出限范围0.02 ~ 0.04 μg/mL,定量下限范围0.08 ~ 0.20 μg/mL;在空白尿样中添加0.5、10.0、40.0 μg/mL 3个水平的混合标准溶液时,各待测物的回收率为92.0% ~ 104%,相对标准偏差为2.2% ~ 6.6%;尿液在- 18 ℃条件下至少可放置14 d。结论 建立的尿中4种酰胺类测定方法灵敏度高、准确可靠,适用于职业工人尿样中DMF、DMAC、NMF、NMAC的同时测定。
-
N,N-二甲基甲酰胺(N,N-dimethylformamide,DMF)和N,N-二甲基乙酰胺(N,N- dimethylacetamide,DMAC)是良好的工业有机溶剂,在腈纶纺丝、石油化工、医药、电子等多个行业中广泛应用,具有相当数量的职业暴露人群。这些化合物一般经呼吸道进入体内,也能通过皮肤吸收。DMF和DMAC在体内代谢的主要产物是甲基甲酰胺(N-methylformamide,NMF)和甲基乙酰胺(N-methylacetamide,NMAC),还有少部分未转化的DMF和DMAC以原形从尿中排出[1]。美国政府工业卫生学家协会(ACGIH)和德意志研究会(DFG)将NMF和NMAC这两种代谢物分别作为评估DMF和DMAC暴露水平的主要生物指标。
工作实践中发现有企业同时使用DMF和DMAC,但目前有关同时检测尿中4种待测物的方法尚未见报道。本研究拟采用液液萃取-气相色谱法,通过优化萃取条件和气相色谱检测条件,建立一种可以同时测定尿中DMF、DMAC、NMF和NMAC的检测方法。
1. 材料与方法
1.1 仪器与试剂
7890 B型气相色谱仪,配氮磷检测器(NPD),带自动进样器,购于美国安捷伦公司;色谱柱(HP-Innowax毛细管柱),购于美国安捷伦公司;漩涡振荡器(Stuart SA8型),购于英国Bio Cote公司;大容量通风型离心机(Sorvall ST 16型),购于美国赛默飞公司。
DMF、DMAC标准品(纯度≥ 99.0%,阿拉丁);NMF、NMAC标准品(纯度≥ 99.0%,东京化成工业株式会社);异丁醇(纯度≥ 99.8%,中国国药集团化学试剂有限公司);NaCl(纯度≥ 99.8%,中国国药集团化学试剂有限公司)。
1.2 方法
1.2.1 仪器操作条件
色谱柱:HP-Innowax毛细管柱(30 m × 0.32 mm × 0.50 μm);载气:氮气;流速:1.0 mL/min;进样口温度:230 ℃;分流进样:10∶1;程序升温:初始温度80 ℃,以20 ℃/min升至150 ℃,保持1 min,再以30 ℃/min升至230 ℃;进样量:1.0 μL;检测器温度:290 ℃。
1.2.2 标准储备液及工作曲线绘制
于10 mL容量瓶中加甲醇约5 mL,准确称量后,分别加入一定量的DMF、DMAC、NMF或者NMAC,再准确称量,加甲醇至刻度,作为标准储备液。临用前,再用甲醇稀释成2 000 μg/mL的混合标准溶液。
在6个螺纹样品瓶(瓶盖具聚四氟乙烯隔垫)中,分别加入0、1.0、2.0、10.0、50.0、250.0 μL的混合标准溶液,加健康无接触者的尿液至10.0 mL,配成0、0.2、0.4、2.0、10.0、50.0 μg/mL标准系列,各加入3.6 g NaCl混匀后,再加入2.0 mL异丁醇以2 200 r/min的速率充分萃取3 min,再4 000 r/min离心10 min分层,取上部异丁醇层1 mL左右放入样品瓶,加入约0.2 g无水硫酸钠进行脱水处理,进样1.0 μL上机分析。分别以测得的峰面积与对应的DMF、DMAC、NMF或者NMAC质量浓度(μg/mL)绘制标准曲线。
1.2.3 样品测定
将尿样取出置室温解冻后,取10.0 mL待测尿样按标准曲线前处理方法进行萃取后,在上述色谱条件下,上机分析。保留时间定性,峰面积定量。
1.2.4 统计学分析
采用SPSS 25.0软件进行统计学分析,符合正态分布的计量资料以均数±标准差(x ± s)描述,采用一元线性回归方程分析拟合标准曲线回归方程,并计算直线相关系数r。
2. 结果与讨论
2.1 色谱条件的优化
2.1.1 色谱柱的选择
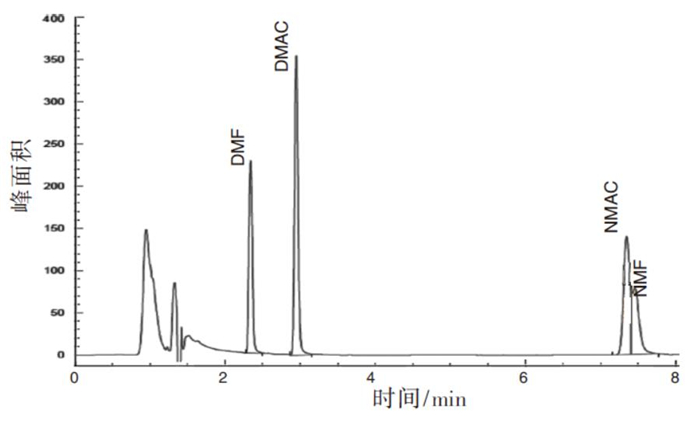
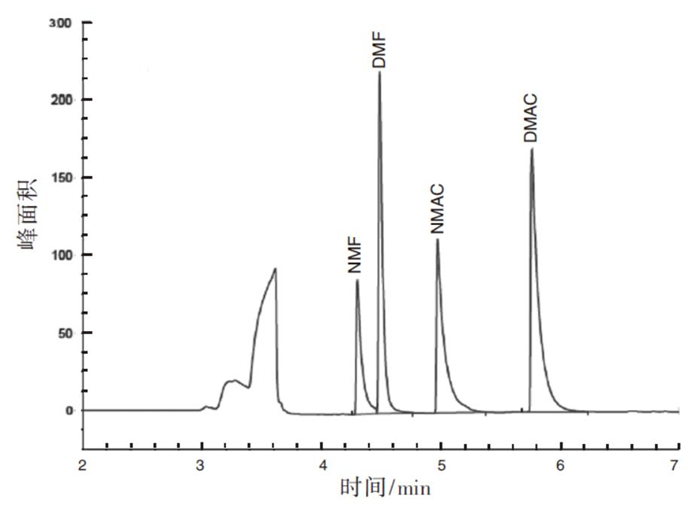
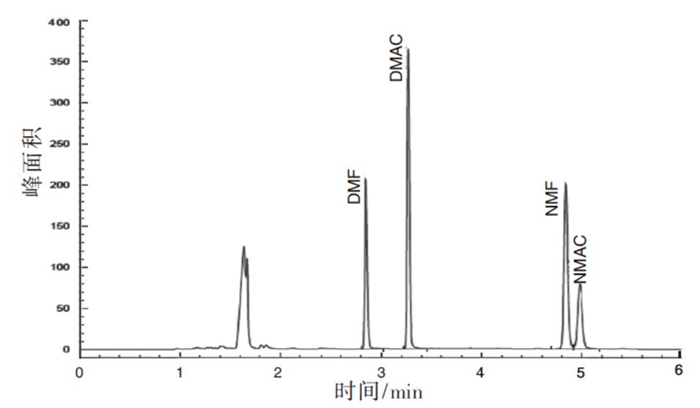
本实验对有机物分析常用的FFAP柱(30 m × 0.25 mm × 0.25 μm)、HP-5柱(30 m× 0.32 mm × 0.25 μm)和Innowax柱(30 m × 0.32 mm × 0.50 μm)进行测试比较,在进样口、分流比和检测器温度等其他条件不变的情况下,调整气相的程序升温和流速,各柱相对最好的分离谱图见图 1~3:NMAC和NMF在FFAP柱上不能很好分离;4种待测物在HP-5柱上的拖尾现象均较为严重;Innowax毛细管柱相对较佳,待测物峰形好,灵敏度高,可实现4种待测物的分离,因此选用Innowax柱。
2.1.2 程序升温的确定
为了能使DMF、NMF、DMAC、NMAC以及尿中其他可能存在的物质相互分开,选择程序升温。通过调节载气流量(1.0、1.5、2.0 mL/min)、升温起始温度(60、80、100 ℃)、升温速率(10、20、30 ℃/min)等因素,达到快速分析样品的目的,同时兼顾灵敏度和分离度。NMF和NMAC两种化合物极性相似,且沸点较为接近,分别为198 ℃和205 ℃,因此较难分离,最终确定升温程序为:初始温度80 ℃,以20 ℃/min升至150 ℃,保持1 min,再以30 ℃/min升至230 ℃,以保证4种物质尤其是NMF和NMAC尽可能分离。
2.2 样品前处理条件的优化
2.2.1 萃取试剂的优化
文献报道有多种前处理方法,如离心后直接进样法[2]、甲醇处理法[3-6]、萃取法[7-10]等。直接进样法和甲醇处理法相对简单,但尿样盐类杂质较多且含有水分,影响色谱柱和检测器寿命,而萃取法可以解决这一问题。
将4种待测物加入健康无接触者的尿液中,配制成质量浓度为10.0 μg/mL的溶液,加入3.6 g NaCl,混匀后,将2.0 mL萃取剂加入其中进行萃取。比较了三氯甲烷、二氯甲烷、乙酸乙酯、正己烷、异丁醇、正丁醇、正戊醇7种常见的萃取溶剂,包含已有文献报道的三氯甲烷[8]和乙酸乙酯[9-10],对4种待测物的萃取效率进行比较,结果见表 1。大部分有机溶剂对NMF和NMAC的萃取效率(以峰面积计)较DMF和DMAC低,正己烷和乙酸乙酯对4种待测物的萃取效率均较差,而二氯甲烷和三氯甲烷虽然对DMF和DMAC的萃取效率较高,但是对NMF和NMAC的萃取效率却较低。综合4种化合物的萃取效率,出于保护色谱柱和检测器及满足方法检出限的考虑,本实验选用异丁醇作为萃取试剂。
表 1 不同萃取试剂下4种待测物的峰面积响应值均值(n = 6) 萃取试剂 DMF DMAC NMF NMAC 乙酸乙酯 119 138 64 55 正己烷 15 17 11 14 二氯甲烷 866 1 054 98 48 正丁醇 357 576 556 286 三氯甲烷 1 079 1 380 122 44 异戊醇 692 518 479 225 异丁醇 396 640 569 294 2.2.2 萃取时间的优化
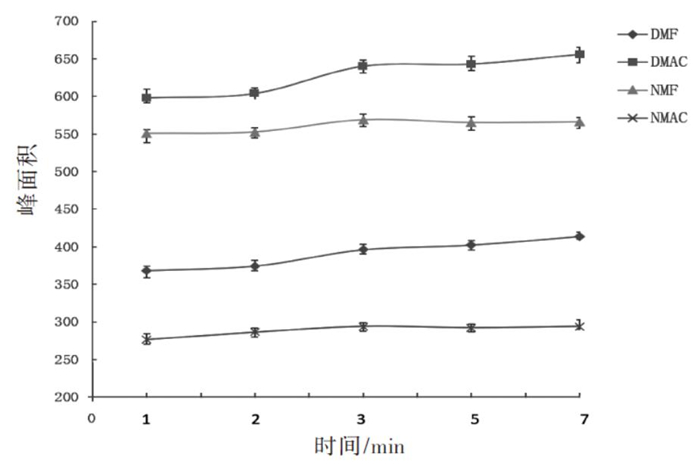
将4种待测物加入健康无接触者的尿液中,配制成质量浓度为10.0 μg/mL的溶液,加入3.6 g NaCl,混匀后,加入2.0 mL异丁醇进行萃取,分别振摇1.0、2.0、3.0、5.0、7.0 min,从图 4可以看出3.0 min后,待测物响应值趋于稳定,因此确定萃取时间为3.0 min。
2.2.3 NaCl加入量的优化
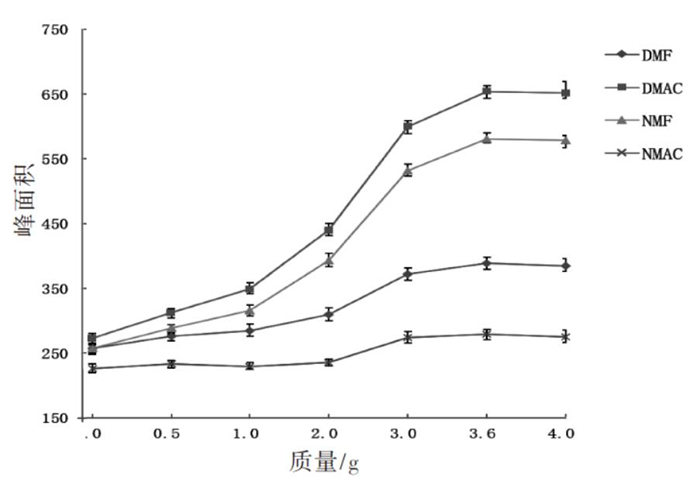
将4种待测物加入健康无接触者的尿液中,配制成质量浓度为10.0 μg/mL的溶液,分别加入0、0.5、1.0、2.0、3.0、3.6、4.0 g NaCl,混匀后,加入2.0 mL异丁醇进行萃取分析。从图 5可以看出,随着NaCl加入量的增大,4种待测物的峰面积响应值均逐步升高,可见NaCl的加入有利于提高萃取效率。且实验过程中发现随着NaCl使用量的增加,萃取过程中的乳化现象得以改善,有机相和水相可以更快更好地分离。加入3.6 g和4.0 g时待测物响应值接近,这是因为20 ℃时NaCl在水中的溶解度为36.0 g,故在尿中加入3.6 g的NaCl进行萃取。
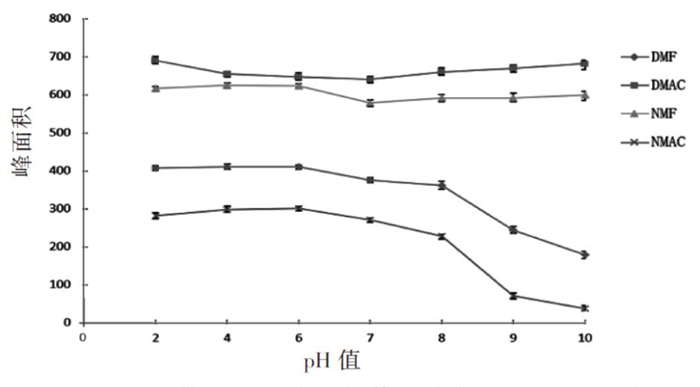
2.2.4 pH值的影响
本实验用盐酸和氢氧化钠调节尿液pH值,分别配制了pH值为2.0、4.0、6.0、7.0、8.0、9.0、10.0且4种待测物的质量浓度均为10.0 μg/mL的尿样,取10.0 mL样品进行分析。图 6可以看出,当pH值在8以上时,待测物DMF和NMAC的响应值较低,而pH值在2.0 ~ 8.0这个范围内4种待测物响应值相对稳定且均较高。考虑到尿的pH值参考区间在4.5 ~ 8.0 [11],本实验不对尿液的pH值进行调节。
2.3 方法线性范围及检出限
用健康无接触者的尿液配制0.2 ~ 50.0 μg/mL的DMF、DMAC、NMF和NMAC混合标准系列,用前述方法进行测定,用峰面积对浓度绘制标准曲线,以3倍噪声对应的待测物浓度作为方法的检出限,10倍标准偏差计算方法定量下限(以取尿样10.0 mL计)。结果见表 2。
表 2 方法线性范围、检出限、定量下限(n = 11)待测物 回归方程 相关系数 线性范围/(μg/mL) 检出限/(μg/mL) 定量下限/(μg/mL) DMF A = 37.347 20
C - 2.328 870.999 8 0.2 ~ 50.0 0.03 0.14 DMAC A = 61.588 04
C - 4.825 100.999 9 0.2 ~ 50.0 0.02 0.08 NMF A = 54.270 39
C - 4.395 570.999 5 0.2 ~ 50.0 0.03 0.11 NMAC A = 25.301 32
C - 2.116 780.999 6 0.2 ~ 50.0 0.04 0.20 注:A为峰面积,C为质量浓度(单位为μg/mL)。 2.4 方法的精密度和回收率
在空白尿样中添加质量浓度为0.5、10.0、40.0 μg/mL的混合标准溶液。按照样品测定方法进行分析,重复测定6次,计算相对标准偏差(RSD)和回收率。1 d内,相同实验条件下,每种浓度做6个平行样,测日内精密度;相同实验条件下,每种浓度做3个平行样,连续测定3 d,测日间精密度。结果显示,精密度为2.2% ~ 6.6%,回收率为92.0% ~ 104.0%。日内精密度和日间精密度测定结果的相对标准偏差均 < 10%,满足卫生标准的要求[12]。见表 3。
表 3 精密度和回收率测定结果待测物 浓度/(μg/mL) 日内精密度(n = 6) 日间精密度(n = 6) 检测值/(μg/mL) RSD/% 回收率/% 检测值/(μg/mL) RSD/% 回收率/% DMF 0.5 0.51 ± 0.03 6.6 102.0 0.52 ± 0.03 6.4 104.0 10.0 9.56 ± 0.25 2.6 95.6 9.41 ± 0.28 3.0 94.1 40.0 37.5 ± 0.82 2.2 93.8 37.20 ± 1.23 3.3 93.0 DMAC 0.5 0.46 ± 0.03 6.1 92.0 0.47 ± 0.03 6.4 94.0 10.0 9.43 ± 0.41 4.4 94.3 9.33 ± 0.43 4.6 93.3 40.0 38.60 ± 1.32 3.4 96.5 38.9 ± 1.02 2.6 97.3 NMF 0.5 0.51 ± 0.03 5.1 102.0 0.49 ± 0.02 4.9 98.0 10.0 9.46 ± 0.35 3.7 94.6 9.44 ± 0.33 3.5 94.4 40.0 38.70 ± 1.55 4.0 96.8 38.50 ± 1.57 4.1 96.3 NMAC 0.5 0.51 ± 0.03 5.5 102.0 0.52 ± 0.03 5.8 104.0 10.0 9.50 ± 0.29 3.1 95.0 9.56 ± 0.35 3.7 95.6 40.0 38.5 ± 0.87 2.3 96.3 38.10 ± 1.20 3.2 95.3 2.5 样品的稳定性实验
用空白尿样分别配制0.50、10.0、40.0 μg/mL 3种不同质量浓度的混合标准溶液,在-18 ℃下保存,分别在第0、3、7、14天测定样品,计算待测物浓度变化。尿样在-18 ℃冰箱中保存14 d后待测物浓度下降率为1.0% ~ 8.8%,按照卫生标准[12]下降率≤ 10%的天数为稳定时间,样品在此条件下至少可以保存14 d。见表 4。
表 4 稳定性浓度均值测定结果(n = 6)待测物 第0天 第3天 第7天 第14天 测定值/(μg/mL) 测定值/(μg/mL) 下降率/% 测定值/(μg/mL) 下降率/% 测定值/(μg/mL) 下降率/% DMF 0.51 ± 0.03 0.51 ± 0.03 0.0 0.49 ± 0.04 3.9 0.47 ± 0.04 7.8 9.56 ± 0.25 9.41 ± 0.28 1.6 9.31 ± 0.25 2.7 9.21 ± 0.26 3.7 37.50 ± 0.82 37.22 ± 1.23 0.8 36.22 ± 1.03 3.5 34.18 ± 1.33 8.8 DMAC 0.46 ± 0.03 0.46 ± 0.03 0.0 0.45 ± 0.03 2.2 0.44 ± 0.03 4.4 9.43 ± 0.41 9.40 ± 0.43 0.3 9.36 ± 0.45 0.7 9.32 ± 0.42 1.2 38.60 ± 1.32 38.53 ± 1.22 0.3 38.31 ± 1.32 0.8 37.88 ± 1.22 1.8 NMF 0.51 ± 0.03 0.49 ± 0.03 3.9 0.48 ± 0.02 5.9 0.47 ± 0.03 7.8 9.46 ± 0.36 9.44 ± 0.31 0.2 9.42 ± 0.38 0.4 9.37 ± 0.34 1.0 38.67 ± 1.55 38.52 ± 1.52 0.5 38.22 ± 1.46 1.3 37.53 ± 1.62 3.1 NMAC 0.51 ± 0.03 0.51 ± 0.02 0.0 0.50 ± 0.03 2.0 0.49 ± 0.03 3.9 9.50 ± 0.29 9.50 ± 0.34 0.0 9.45 ± 0.32 0.5 9.41 ± 0.31 1.0 38.52 ± 0.87 38.01 ± 1.20 1.3 37.89 ± 1.33 1.6 37.92 ± 1.29 1.6 3. 讨论
本实验建立了尿中4种酰胺类物质同时测定的液液萃取气相色谱法。方法的检出限、准确度、精密度和回收率等均符合卫生标准的要求,可用于DMF和DMAC接触的人群尿样中DMF、DMAC及其代谢产物NMF、NMAC的同时测定。
作者声明 本文无实际或潜在的利益冲突 -
表 1 不同萃取试剂下4种待测物的峰面积响应值均值
(n = 6) 萃取试剂 DMF DMAC NMF NMAC 乙酸乙酯 119 138 64 55 正己烷 15 17 11 14 二氯甲烷 866 1 054 98 48 正丁醇 357 576 556 286 三氯甲烷 1 079 1 380 122 44 异戊醇 692 518 479 225 异丁醇 396 640 569 294 表 2 方法线性范围、检出限、定量下限(n = 11)
待测物 回归方程 相关系数 线性范围/(μg/mL) 检出限/(μg/mL) 定量下限/(μg/mL) DMF A = 37.347 20
C - 2.328 870.999 8 0.2 ~ 50.0 0.03 0.14 DMAC A = 61.588 04
C - 4.825 100.999 9 0.2 ~ 50.0 0.02 0.08 NMF A = 54.270 39
C - 4.395 570.999 5 0.2 ~ 50.0 0.03 0.11 NMAC A = 25.301 32
C - 2.116 780.999 6 0.2 ~ 50.0 0.04 0.20 注:A为峰面积,C为质量浓度(单位为μg/mL)。 表 3 精密度和回收率测定结果
待测物 浓度/(μg/mL) 日内精密度(n = 6) 日间精密度(n = 6) 检测值/(μg/mL) RSD/% 回收率/% 检测值/(μg/mL) RSD/% 回收率/% DMF 0.5 0.51 ± 0.03 6.6 102.0 0.52 ± 0.03 6.4 104.0 10.0 9.56 ± 0.25 2.6 95.6 9.41 ± 0.28 3.0 94.1 40.0 37.5 ± 0.82 2.2 93.8 37.20 ± 1.23 3.3 93.0 DMAC 0.5 0.46 ± 0.03 6.1 92.0 0.47 ± 0.03 6.4 94.0 10.0 9.43 ± 0.41 4.4 94.3 9.33 ± 0.43 4.6 93.3 40.0 38.60 ± 1.32 3.4 96.5 38.9 ± 1.02 2.6 97.3 NMF 0.5 0.51 ± 0.03 5.1 102.0 0.49 ± 0.02 4.9 98.0 10.0 9.46 ± 0.35 3.7 94.6 9.44 ± 0.33 3.5 94.4 40.0 38.70 ± 1.55 4.0 96.8 38.50 ± 1.57 4.1 96.3 NMAC 0.5 0.51 ± 0.03 5.5 102.0 0.52 ± 0.03 5.8 104.0 10.0 9.50 ± 0.29 3.1 95.0 9.56 ± 0.35 3.7 95.6 40.0 38.5 ± 0.87 2.3 96.3 38.10 ± 1.20 3.2 95.3 表 4 稳定性浓度均值测定结果(n = 6)
待测物 第0天 第3天 第7天 第14天 测定值/(μg/mL) 测定值/(μg/mL) 下降率/% 测定值/(μg/mL) 下降率/% 测定值/(μg/mL) 下降率/% DMF 0.51 ± 0.03 0.51 ± 0.03 0.0 0.49 ± 0.04 3.9 0.47 ± 0.04 7.8 9.56 ± 0.25 9.41 ± 0.28 1.6 9.31 ± 0.25 2.7 9.21 ± 0.26 3.7 37.50 ± 0.82 37.22 ± 1.23 0.8 36.22 ± 1.03 3.5 34.18 ± 1.33 8.8 DMAC 0.46 ± 0.03 0.46 ± 0.03 0.0 0.45 ± 0.03 2.2 0.44 ± 0.03 4.4 9.43 ± 0.41 9.40 ± 0.43 0.3 9.36 ± 0.45 0.7 9.32 ± 0.42 1.2 38.60 ± 1.32 38.53 ± 1.22 0.3 38.31 ± 1.32 0.8 37.88 ± 1.22 1.8 NMF 0.51 ± 0.03 0.49 ± 0.03 3.9 0.48 ± 0.02 5.9 0.47 ± 0.03 7.8 9.46 ± 0.36 9.44 ± 0.31 0.2 9.42 ± 0.38 0.4 9.37 ± 0.34 1.0 38.67 ± 1.55 38.52 ± 1.52 0.5 38.22 ± 1.46 1.3 37.53 ± 1.62 3.1 NMAC 0.51 ± 0.03 0.51 ± 0.02 0.0 0.50 ± 0.03 2.0 0.49 ± 0.03 3.9 9.50 ± 0.29 9.50 ± 0.34 0.0 9.45 ± 0.32 0.5 9.41 ± 0.31 1.0 38.52 ± 0.87 38.01 ± 1.20 1.3 37.89 ± 1.33 1.6 37.92 ± 1.29 1.6 -
[1] LAREO A C, PERBELLINI L. Biological monitoring of workers exposed to N-N-dimethylformamide. Ⅱ. Dimethylformamide and its metabolites in urine of exposed workers[J]. Int Arch Occup Environ Health, 1995, 67(1): 47-52. doi: 10.1007/BF00383132
[2] 张伟, 林华影, 陈柯星. 毛细管气相色谱法测定尿中N-甲基甲酰胺[J]. 中国卫生检验杂志, 2009, 19(7): 1496-1497. https://www.cnki.com.cn/Article/CJFDTOTAL-ZWJZ200907019.htm [3] 田寒梅, 崔蓉, 阮明, 等. 毛细管气相色谱法同时测定尿中N-甲基甲酰胺和N, N-二甲基甲酰胺[J]. 中国卫生检验杂志, 2009, 19(8): 1701-1704. https://www.cnki.com.cn/Article/CJFDTOTAL-ZWJZ200908002.htm [4] 刘丹华, 唐红芳, 阮征, 等. 气相色谱法同时测定尿中N-甲基甲酰胺和N-甲基乙酰胺的含量[J]. 中国卫生检验杂志, 2012, 22(3): 422-424. https://www.cnki.com.cn/Article/CJFDTOTAL-ZWJZ201203004.htm [5] 李启, 雷永良, 傅艳岚, 等. 气相色谱法测定工人和居民尿中N-甲基甲酰胺和N-甲基乙酰胺[J]. 中国卫生检验杂志, 2017, 27(9): 1240-1243. https://www.cnki.com.cn/Article/CJFDTOTAL-ZWJZ201709007.htm [6] 中华人民共和国卫生部. 尿中N-甲基乙酰胺的测定气相色谱法: GBZ/T 312—2018[S]. 北京: 中国标准出版社, 2018. [7] 洪萍, 李峰, 韩见龙. 活性炭固相萃取-气相色谱-质谱法检测人尿中N, N-二甲基乙酰胺和N-甲基乙酰胺[J]. 分析化学, 2013, 41(9): 1396-1400. https://www.cnki.com.cn/Article/CJFDTOTAL-FXHX201309021.htm [8] 朱琳, 许莹, 徐峰. 溶剂萃取气相色谱法测定空气中二甲基甲酰胺和二甲基乙酰胺[J]. 中国工业医学杂志, 2007, 20(6): 416-417. https://www.cnki.com.cn/Article/CJFDTOTAL-SOLE200706031.htm [9] 李峰, 洪萍, 应杏秋. GC/MS同时检测人尿中N, N-二甲基乙酰胺及其代谢产物N-甲基乙酰胺[J]. 中国卫生检验杂志, 2011, 21(2): 304-305;308. https://www.cnki.com.cn/Article/CJFDTOTAL-ZWJZ201111013.htm [10] 吴邦华, 叶能权, 张子群, 等. GC/MS法同时检测尿中N, N-二甲基甲酰胺及其代谢产物N-甲基甲酰胺[J]. 中国卫生检验杂志, 2002, 12(1): 23-25. https://www.cnki.com.cn/Article/CJFDTOTAL-ZWJZ200201008.htm [11] 尚红, 王毓三, 申子瑜. 全国临床检验操作规程[M]. 4版. 北京: 人民卫生出版社, 2015. [12] 中华人民共和国卫生部. 职业卫生标准制定指南 第5部分: 生物材料中化学物质测定方法: GBZ/T 210.5-2008[S]. 北京: 中国标准出版社, 2008.





 下载:
下载: