Determination of fenthion and its main metabolites in plasma by ultra-performance liquid chromatography
-
+ English摘要:目的
建立血浆中倍硫磷及其5种代谢物(倍硫磷氧化物、倍硫磷砜、倍硫磷亚砜、倍硫磷氧砜和倍硫磷氧亚砜)的超高效液相色谱(UPLC)测定方法。
方法取0.50 mL待测血浆经乙酸乙酯+乙腈混合溶液(体积比1∶1)萃取,氮气吹干,甲醇定容,采用ACQUITY UPLC BEH C18柱分离,以甲醇和甲酸水溶液为流动相梯度洗脱,二极管阵列检测器检测,以保留时间和吸收光谱定性,以峰面积外标法定量。
结果倍硫磷及其5种代谢物在各自线性范围内相关性良好,相关系数为0.999 8~0.999 9;检出限0.1~0.2 mg/L,定量限0.3~0.6 mg/L,加标回收率为87.18%~111.02%。批内精密度为0.52%~9.86%,批间精密度为1.07%~7.19%。除倍硫磷氧砜外,样品可在-40 ℃保存7 d。
结论本方法准确可靠,简便实用,可用于测定血浆中倍硫磷及其5种代谢物。
-
倍硫磷(fenthion)是一种典型的有机磷农药,常见的商品剂型主要有颗粒剂和乳油。我国自2007年1月1日起全面禁止使用甲胺磷、对硫磷、甲基对硫磷、久效磷和磷胺5种高毒有机磷农药后,倍硫磷等低毒类农药使用更为广泛[1],造成的中毒病例也日益增多[2-3]。倍硫磷在哺乳动物体内的代谢过程和主要代谢产物比较清楚,倍硫磷原型主要在细胞色素氧化酶系和黄素单氧化酶的催化作用下生成倍硫磷氧化物、倍硫磷砜、倍硫磷亚砜、倍硫磷氧砜和倍硫磷氧亚砜5种代谢产物,氧化代谢产物的毒性高于倍硫磷原型[4]。目前,针对水[5]、牛奶[6]、蔬菜[7]、水果[8]等环境样品中倍硫磷及其代谢产物的检测方法虽已有报道[9-11],但尚未见血浆中倍硫磷及其代谢产物的检测方法。本研究拟建立血浆中倍硫磷及其代谢产物的超高效液相色谱检测方法,并对建立的方法进行评价。
1. 材料与方法
1.1 材料
1.1.1 仪器
ACQUITY超高效液相色谱(UPLC)仪(美国Waters公司);DC-12氮吹仪(上海安谱科学仪器有限公司);Simplicity UV超纯水系统(法国Millipore公司);AUW220D 1/10万电子天平(日本岛津公司);MS3漩涡混匀器(德国IKA公司);小型高速离心机(Microfuge 16,德国Beckman公司)。
1.1.2 试剂耗材
亲水聚四氟乙烯针式滤器(PTFE,13 mm,0.22 μm)、疏水聚四氟乙烯针式滤器(PTFE,13 mm,0.22 μm)、有机相针式滤器(尼龙)(13 mm,0.22 μm)均购自上海安谱实验科技股份有限公司;固相支撑液液萃取柱(ISOLUTE SLE+,瑞典Biotage公司);ACQUITY UPLC BEH C18柱(50.00 mm × 2.10 mm × 1.70 μm,美国Waters公司)。乙酸乙酯、乙腈、甲苯、异丙醇、甲醇、甲酸(均为色谱纯),以及倍硫磷(质量分数95.5%)、倍硫磷氧化物(质量分数99.9%)、倍硫磷亚砜(质量分数98.2%)、倍硫磷氧化亚砜(质量分数99.9%)均购自上海安谱璀世标准技术服务有限公司;倍硫磷砜(质量分数99.0%)购自天津阿尔塔科技有限公司,倍硫磷氧砜(质量分数98.8%)购自坛墨质检标准物质中心,倍硫磷乳油(质量分数50%)购自浙江吉顺植物科技有限公司;马血浆购自平睿生物科技有限公司。
1.2 方法
1.2.1 色谱条件
以ACQUITY UPLC BEH C18柱分离,流动相A为甲醇,流动相B为质量分数0.1%的甲酸水溶液,二元梯度洗脱分离,梯度洗脱程序,见表 1。柱温为40 ℃,样品室温度为4 ℃,流动相流速为0.3 mL/min,进样体积为2 μL。以光电二极管列阵检测器(photo-diode array,PDA)检测。
表 1 二元梯度洗脱程序序号 时间/min 流动相A/% 流动相B/% 梯度曲线 1 0 80 20 2 6.00 0 100 6 3 8.50 0 100 1 4 8.60 80 20 1 5 10.00 80 20 1 1.2.2 标准溶液的配制
分别称取倍硫磷及其代谢产物各50.00 mg,置于5.00 mL容量瓶中,用乙腈溶解定容,配制成质量浓度为10.00 mg/mL的标准储备液,避光保存。
1.2.3 标准系列配制和测定
分别取质量浓度为10.00 mg/mL倍硫磷及其5种代谢产物的混合标准储备液,用甲醇稀释成质量浓度分别为10.00、20.00、30.00、40.00和50.00 mg/L的混合标准系列,将UPLC仪调至最佳状态后,按照1.2.1节的色谱条件进行测定。以保留时间和吸收光谱定性,以峰面积定量,计算回归方程。
1.2.4 样品前处理
取0.50 mL血浆于2.00 mL离心管中,加入1.00 mL乙酸乙酯+乙腈混合溶液(体积比1:1),漩涡振荡5.00 min,4 ℃、14 800 r/min离心3.00 min(离心半径15 cm),取上层有机相,下层再次加入1.00 mL乙酸乙酯+乙腈混合溶液重复萃取1次,合并有机相,25 ℃氮气吹至近干,残留物以0.50 mL甲醇溶解,漩涡振荡60 s,0.22 μm亲水PTFE过滤器过滤后待测。
2. 结果
2.1 色谱条件的选择
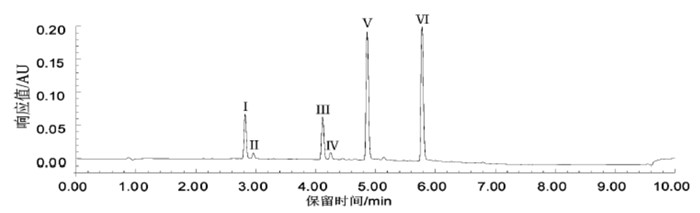
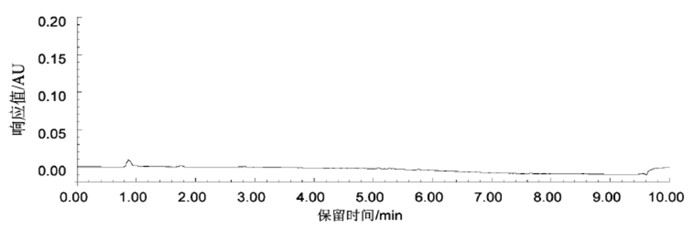
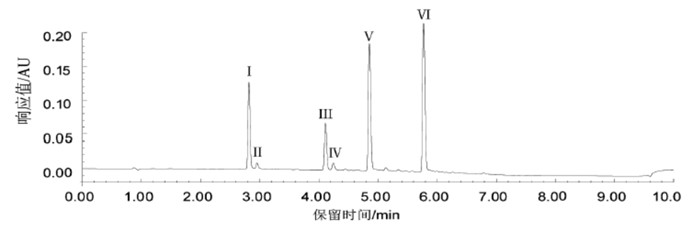
根据1.2.1节条件进样,倍硫磷及其5种代谢物(Ⅰ:倍硫磷氧亚砜、Ⅱ:倍硫磷氧砜、Ⅲ:倍硫磷亚砜、Ⅳ:倍硫磷砜、Ⅴ:倍硫磷氧化物、Ⅵ:倍硫磷;下文Ⅰ~ Ⅵ指代与此相同)在6.00 min内得到良好分离,标准品、空白血浆和加标血浆色谱图见图 1、2和3。
2.2 萃取剂的选择
取0.50 mL空白血浆于2.00 mL离心管中,加入混合标准溶液,配制成质量浓度均为50.00 mg/L的倍硫磷及其5种代谢产物的加标血浆。(1)传统液液萃取:取0.50 mL加标血浆分别使用乙酸乙酯、乙腈、乙酸乙酯+乙腈混合溶液(体积比1∶1)和甲苯+异丙醇混合溶液(体积比1∶1)为萃取液,按照1.2.4节方法萃取,重复6次。(2)固相支撑的液液萃取,取0.50 mL加标血浆置于固相支撑柱中,5 min后加入1.5 mL乙酸乙酯淋洗2次,收集洗脱液,25 ℃氮气吹至近干,残留物以0.50 mL甲醇溶解,漩涡振荡60 s,0.22 μm无机相滤膜过滤后待测。结果显示,固相支撑的液液萃取和乙酸乙酯+乙腈混合溶液对倍硫磷的5种代谢产物回收率均较高,但固相支撑的液液萃取对倍硫磷原型的回收率欠佳,其他液液萃取溶剂的回收率均低于乙酸乙酯+乙腈混合溶液。综合考虑加标回收率、有机溶剂的毒性、经济性和方便程度,选择乙酸乙酯+乙腈(体积比1∶1)液液萃取作为样品前处理的方法。见表 2。
表 2 不同样品前处理方法对倍硫磷及其5种代谢产物加标回收率的影响待测物 固相支撑液液萃取 乙酸乙酯 乙腈 乙酸乙酯+乙腈 甲苯+异丙醇 Ⅰ 实测值/(mg/L) 53.07±4.08 44.91±0.00 45.20±0.51 51.10±1.04 44.92±2.07 加标回收率/% 106.15 89.83 90.41 102.20 89.84 Ⅱ 实测值/(mg/L) 46.00±3.14 45.33±0.67 42.78±2.09 50.41±1.44 44.04±1.00 加标回收率/% 92.01 90.67 85.56 100.82 88.08 Ⅲ 实测值/(mg/L) 51.02±3.31 48.29±0.03 47.18±1.3 50.70±2.20 46.27±1.02 加标回收率/% 102.05 96.59 94.36 101.40 92.54 Ⅳ 实测值/(mg/L) 51.23±5.88 46.01±0.12 38.87±4.07 49.97±1.78 39.69±4.90 加标回收率/% 102.46 92.02 77.75 99.95 79.38 Ⅴ 实测值/(mg/L) 48.18±2.41 46.72±0.16 38.32±0.67 51.54±5.08 41.56±2.69 加标回收率/% 96.37 93.45 76.65 103.09 83.12 Ⅵ 实测值/(mg/L) 34.49±4.66 40.83±0.11 40.53±0.49 49.66±3.91 40.53±0.99 加标回收率/% 68.99 81.67 81.07 99.33 81.07 2.3 滤器的选择
取质量浓度为10.00 mg/mL的混合标准储备液,用甲醇稀释成质量浓度分别为2.00、10.00和50.00 mg/L的混合标准溶液,分别过亲水聚四氟乙烯针式滤器、疏水聚四氟乙烯针式滤器和有机相针式滤器(尼龙),按照1.2.1节的色谱条件检测。不同滤器过滤倍硫磷及其5种代谢产物的回收率见表 3,有机相针式滤器(尼龙)对部分成分有增强作用,亲水聚四氟乙烯针式滤器、疏水聚四氟乙烯针式滤器对倍硫磷及其5种代谢产物的回收率无明显影响。
表 3 不同滤器对倍硫磷及其5种代谢产物回收率的影响待测物 亲水PTFE 疏水PTFE 有机相(尼龙) 2.00 mg/L 10.00 mg/L 50.00 mg/L 2.00 mg/L 10.00 mg/L 50.00 mg/L 2.00 mg/L 10.00 mg/L 50.00 mg/L Ⅰ 实测值/(mg/L) 1.94±0.06 10.02±0.11 50.00±0.79 1.94±0.05 9.93±0.04 49.93±0.62 2.37±0.23 10.40±0.03 50.16±0.28 加标回收率/% 96.83 100.54 99.41 97.2 99.32 99.85 118.54 104.05 100.32 Ⅱ 实测值/(mg/L) 2.06±0.05 10.05±0.1 49.71±0.29 2.04±0.1 10.05±0.05 50.29±0.68 2.08±0.05 9.95±0.07 50.58±0.26 加标回收率/% 102.81 100.95 99.09 101.85 100.45 100.59 104.22 99.49 101.15 Ⅲ 实测值/(mg/L) 1.99±0.01 10.15±0.11 49.91±0.18 1.96±0.02 10.14±0.02 50.33±0.73 1.98±0.04 10.15±0.04 50.28±0.23 加标回收率/% 99.28 102.04 99.64 98.18 101.36 100.66 98.89 101.51 100.57 Ⅳ 实测值/(mg/L) 2.04±0.07 10.05±0.02 50.10±0.02 2.04±0.12 9.99±0.09 50.56±0.46 2.00±0.20 9.99±0.08 49.29±2.43 加标回收率/% 102.02 100.72 100.29 101.77 99.91 101.11 100.06 99.9 98.57 Ⅴ 实测值/(mg/L) 2.00±0.01 10.09±0.09 49.95±0.19 1.97±0.01 10.10±0.04 50.11±0.44 1.99±0.03 10.08±0.01 50.01±0.26 加标回收率/% 100.01 101.33 99.74 98.66 100.98 100.22 99.4 100.76 100.02 Ⅵ 实测值/(mg/L) 1.99±0.01 10.00±0.03 49.84±0.53 1.98±0.01 9.92±0.01 50.19±0.54 1.95±0.04 9.93±0.02 49.84±0.24 加标回收率/% 99.72 99.9 99.91 99.22 99.17 100.38 97.67 99.33 99.68 2.4 进样量的选择
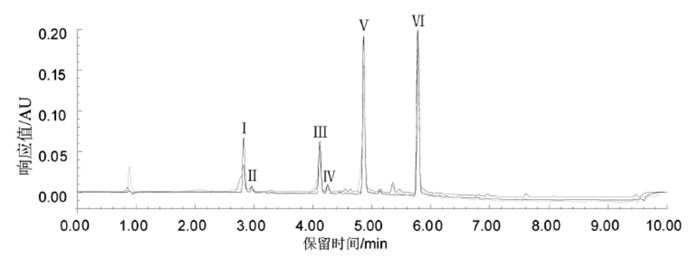
取质量浓度为50.00 mg/mL、20 mg/mL和10 mg/mL的混合标准溶液,分别以2 μL、5 μL和10 μL进样,进样目标化合物均为0.1 mg。按照1.2.1节的色谱条件检测。结果发现随着进样量的增加,Ⅰ、Ⅱ和Ⅲ峰型变差,见图 4,故选择2 μL进样量进行检测。
2.5 吸收波长的选择
以二极管阵列检测器200 ~ 400 nm对各出峰组分进行扫描,选择各组分最大吸收波长作为检测波长,为避免检测波长的影响,在摸索前处理及色谱分析条件时均以251 nm作为检测波长。物质Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ和Ⅵ的最大吸附波长分别为237.7 nm、225.9 nm、240.1 nm、230.6 nm、250.7 nm和251.9 nm。各组分紫外吸收光谱见图 5。
2.6 线性范围和检出限
在本方法检测条件下,倍硫磷氧亚砜、倍硫磷氧砜、倍硫磷亚砜、倍硫磷砜、倍硫磷氧化物和倍硫磷分别在0.60 ~ 50.00 mg/L、0.30 ~ 50.00 mg/L、0.60 ~ 50.00 mg/L、0.30 ~ 50.00 mg/L、0.30 ~ 50.00 mg/L和0.30~ 50.00 mg/L范围内线性关系良好,相关系数为0.999 8 ~ 0.999 9,以3倍信噪比确定的检出限分别为0.1~ 0.2 mg/L,以10倍信噪比确定的定量限为0.3 ~ 0.6 mg/L。标准曲线、相关系数、检出限和定量限见表 4。
表 4 倍硫磷及其5种代谢产物的线性范围和灵敏度物质名称 保留时间/min 最大吸收波长/nm 回归方程 相关系数 检出限/(mg/L) 定量限/(mg/L) 倍硫磷氧亚砜 2.818 238 ŷ=7 257.1x-1 339.1 0.999 8 0.2 0.6 倍硫磷氧砜 2.955 226 ŷ=12 568.0x-4 634.4 0.999 9 0.1 0.3 倍硫磷亚砜 4.109 240 ŷ=7 694.1x-1 048.0 0.999 8 0.2 0.6 倍硫磷砜 4.243 230 ŷ=11 805.0x-3 411.1 0.999 8 0.1 0.3 倍硫磷氧化物 4.853 251 ŷ=12 968.0x-2 820.6 0.999 8 0.1 0.3 倍硫磷 5.778 252 ŷ=11 964.0x-716.5 0.999 8 0.1 0.3 2.7 准确度和精密度实验
分别取0.50 mL空白血浆,加入一定量的倍硫磷及其5种代谢产物混合标准溶液,配制成倍硫磷及其5种代谢产物质量浓度均为2.00、10.00和50.00 mg/L的加标血浆,每组6个样品,按照1.2.1和1.2.2的方法测定倍硫磷及其5种代谢产物,计算加标回收率为87.18% ~ 111.02%,批内精密度为0.52% ~ 9.86%。参照批内精密度实验的方法配制加标血浆,在7 d内测定6次,每次6个样品,代入当日制作的回归方程计算倍硫磷及其5种代谢产物,计算批间加标回收率为71.50% ~ 107.50%,批间精密度(RSD)为1.07% ~ 7.19%。见表 5。
表 5 倍硫磷及其5种代谢产物的加标回收率和精密度待测物 批内 批间 2.00 mg/L 10.00 mg/L 50.00 mg/L 2.00 mg/L 10.00 mg/L 50.00 mg/L Ⅰ 实测值/(mg/L) 2.01±0.02 10.05±0.13 51.10±1.04 1.78±0.03 9.34±0.13 47.58±0.51 加标回收率/% 100.74 100.53 102.2 89 93.4 95.16 RSD/% 1.00 1.29 2.04 1.94 1.39 1.07 Ⅱ 实测值/(mg/L) 1.74±0.04 9.2±0.06 50.41±1.44 1.43±0.02 9.06±0.15 48.23±1.10 加标回收率/% 87.18 92.01 100.82 71.50 90.60 96.46 RSD/% 2.30 0.65 2.86 1.47 1.69 2.28 Ⅲ 实测值/(mg/L) 2.22±0.11 10.18±0.18 46.27±1.02 2.15±0.12 10.24±0.54 48.55±2.19 加标回收率/% 111.02 101.84 92.54 107.50 102.40 97.10 RSD/% 4.95 1.77 2.20 5.61 5.29 4.50 Ⅳ 实测值/(mg/L) 2.09±0.04 10.08±0.06 49.97±1.78 1.99±0.14 8.98±0.45 50.38±1.41 加标回收率/% 104.40 100.75 99.95 99.50 89.80 100.76 RSD/% 1.91 0.60 3.56 7.19 4.96 2.80 Ⅴ 实测值/(mg/L) 2.08±0.04 10.88±0.11 51.54±5.08 2.14±0.12 9.60±0.63 47.59±2.08 加标回收率/% 103.86 108.77 103.09 107.00 96.00 95.18 RSD/% 1.92 1.01 9.86 5.67 6.52 4.37 Ⅵ 实测值/(mg/L) 1.92±0.01 10.15±0.12 49.66±3.91 1.78±0.04 8.72±0.19 49.04±2.32 加标回收率/% 95.82 101.52 99.33 89.00 87.20 98.08 RSD/% 0.52 1.18 7.87 2.12 2.21 4.73 2.8 样品稳定性实验
分别配制质量浓度为2.00、10.00和50.00 mg/L的倍硫磷及其5种代谢产物混合加标血浆,分别放置于4 ℃和-40 ℃冰箱中保存,在配制当时、24 h以及第3、7天分别测定样品,每个时间点每组检测6个样品,以配制当时测定结果为基准,计算存放不同时间后的回收率。结果表明,4 ℃保存条件下Ⅰ和Ⅱ在血浆中极不稳定,3 d内快速分解,Ⅲ在血浆中可能由其他组分分解产生,随时间延长有增多的趋势,其他成分相对稳定,随保存时间延长缓慢分解,见表 6。-40 ℃保存条件下Ⅱ仍不稳定,其他成分在7 d内相对稳定,见表 7。建议在实际检测过程中获取血浆样品后尽快进行液液萃取以防部分成分分解,如不能立即萃取需要尽快置于-40 ℃冰箱冻存,以防分解。
表 6 4 ℃保存不同时间倍硫磷及其5种代谢产物的回收率(%) 质量浓度 检测时间 Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ Ⅵ 2 mg/L 1 d 74.73±3.12 0.00±0.00 122.01±7.15 93.82±3.05 111.37±2.75 100.43±3.60 3 d 5.89±0.06 0.00±0.00 126.62±8.02 113.82±21.12 92.02±1.36 84.33±0.76 7 d 5.13±2.05 0.00±0.00 137.49±3.06 81.50±2.66 60.27±5.46 65.25±4.37 10 mg/L 1 d 74.67±15.63 0.00±0.00 118.59±3.47 98.48±3.62 106.97±5.78 95.08±2.78 3 d 14.03±0.39 0.00±0.00 88.56±2.84 51.86±1.65 75.99±0.53 80.98±0.44 7 d 20.78±0.85 0.00±0.00 116.83±1.22 57.59±1.56 50.35±0.60 74.51±2.32 50 mg/L 1 d 96.25±1.99 7.23±0.08 116.76±2.77 98.25±3.45 109.25±1.64 94.01±2.03 3 d 87.46±0.54 0.00±0.00 123.46±0.94 92.30±0.91 100.14±1.40 88.03±2.69 7 d 68.31±1.05 0.00±0.00 118.43±1.51 72.99±2.44 79.46±1.77 72.54±3.24 表 7 -40 ℃保存不同时间倍硫磷及其5种代谢产物的回收率(%) 质量浓度 检测时间 Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ Ⅵ 2 mg/L 1 d 101.79±6.36 36.79±1.03 113.91±1.87 105.92±1.94 90.48±3.74 92.85±3.48 3 d 100.52±6.43 38.82±3.52 117.73±5.82 115.17±2.10 103.39±5.88 118.88±1.95 7 d 89.33±2.21 32.15±1.57 106.00±2.25 69.25±7.36 94.53±2.26 97.50±3.57 10 mg/L 1 d 94.23±1.02 50.89±2.33 92.01±1.40 114.78±2.26 107.96±1.49 102.82±0.42 3 d 91.76±0.81 50.26±2.47 94.31±1.84 116.97±1.06 109.57±1.62 103.01±2.27 7 d 85.82±0.46 53.15±0.83 87.41±3.07 104.58±5.75 102.90±3.80 97.14±5.91 50 mg/L 1 d 99.82±0.20 90.70±0.79 110.43±0.17 110.46±0.32 100.27±0.16 104.17±0.26 3 d 105.17±2.27 93.23±2.67 118.44±1.51 114.18±2.71 99.56±2.68 100.25±3.51 7 d 103.07±1.96 93.05±2.21 121.74±2.26 114.56±2.91 99.99±2.92 100.02±1.84 3. 讨论
大多数有机磷杀虫剂沸点较低,挥发性强,气相色谱法或气相色谱-质谱法是有机磷原型主要的检测方法[12-14]。有机磷杀虫剂经体内氧化、还原、水解和结合反应后,代谢产物极性增强,水溶性增大,从而使之容易经肾脏排出体外[15]。但代谢产物一般沸点升高,难以用气相色谱方法同时直接测定有机磷杀虫剂的原型和代谢产物。UPLC方法不受待测物质挥发性的影响,且分离速度较快[16]。本研究结果显示,在6 min内即可完成倍硫磷及其5种代谢产物的分离和检测。色谱-质谱联用方法固然灵敏度高,对于未知样品的定性优势更明显[6, 17-18],但是UPLC方法仪器成本较低,更为普及,且中毒患者生物样品中的有机磷杀虫剂原型和代谢产物浓度相对较高,二极管阵列检测器的灵敏度也足以满足检测要求。
由于血、尿等生物样品基质复杂,在进行检测前需要进行前处理,常用的前处理方法包括液液萃取、固相萃取等技术[19]。本研究中倍硫磷原型为脂溶性物质,而代谢产物大多在有机溶剂和水中有较高的溶解度,单一有机溶剂萃取回收率较低,故考虑使用乙酸乙酯和乙腈混合溶液进行液液萃取的前处理。
本研究建立了液液萃取,UPLC仪检测血浆中倍硫磷及其5中代谢产物的方法,结果显示,该方法操作简便、检测迅速、精密度、准确度和线性关系良好。该方法可用于倍硫磷中毒患者和中毒动物模型内暴露水平的检测和评估,为中毒患者的诊断、治疗和预后评估提供检测技术保障。
作者声明 本文无实际或潜在的利益冲突 -
表 1 二元梯度洗脱程序
序号 时间/min 流动相A/% 流动相B/% 梯度曲线 1 0 80 20 2 6.00 0 100 6 3 8.50 0 100 1 4 8.60 80 20 1 5 10.00 80 20 1 表 2 不同样品前处理方法对倍硫磷及其5种代谢产物加标回收率的影响
待测物 固相支撑液液萃取 乙酸乙酯 乙腈 乙酸乙酯+乙腈 甲苯+异丙醇 Ⅰ 实测值/(mg/L) 53.07±4.08 44.91±0.00 45.20±0.51 51.10±1.04 44.92±2.07 加标回收率/% 106.15 89.83 90.41 102.20 89.84 Ⅱ 实测值/(mg/L) 46.00±3.14 45.33±0.67 42.78±2.09 50.41±1.44 44.04±1.00 加标回收率/% 92.01 90.67 85.56 100.82 88.08 Ⅲ 实测值/(mg/L) 51.02±3.31 48.29±0.03 47.18±1.3 50.70±2.20 46.27±1.02 加标回收率/% 102.05 96.59 94.36 101.40 92.54 Ⅳ 实测值/(mg/L) 51.23±5.88 46.01±0.12 38.87±4.07 49.97±1.78 39.69±4.90 加标回收率/% 102.46 92.02 77.75 99.95 79.38 Ⅴ 实测值/(mg/L) 48.18±2.41 46.72±0.16 38.32±0.67 51.54±5.08 41.56±2.69 加标回收率/% 96.37 93.45 76.65 103.09 83.12 Ⅵ 实测值/(mg/L) 34.49±4.66 40.83±0.11 40.53±0.49 49.66±3.91 40.53±0.99 加标回收率/% 68.99 81.67 81.07 99.33 81.07 表 3 不同滤器对倍硫磷及其5种代谢产物回收率的影响
待测物 亲水PTFE 疏水PTFE 有机相(尼龙) 2.00 mg/L 10.00 mg/L 50.00 mg/L 2.00 mg/L 10.00 mg/L 50.00 mg/L 2.00 mg/L 10.00 mg/L 50.00 mg/L Ⅰ 实测值/(mg/L) 1.94±0.06 10.02±0.11 50.00±0.79 1.94±0.05 9.93±0.04 49.93±0.62 2.37±0.23 10.40±0.03 50.16±0.28 加标回收率/% 96.83 100.54 99.41 97.2 99.32 99.85 118.54 104.05 100.32 Ⅱ 实测值/(mg/L) 2.06±0.05 10.05±0.1 49.71±0.29 2.04±0.1 10.05±0.05 50.29±0.68 2.08±0.05 9.95±0.07 50.58±0.26 加标回收率/% 102.81 100.95 99.09 101.85 100.45 100.59 104.22 99.49 101.15 Ⅲ 实测值/(mg/L) 1.99±0.01 10.15±0.11 49.91±0.18 1.96±0.02 10.14±0.02 50.33±0.73 1.98±0.04 10.15±0.04 50.28±0.23 加标回收率/% 99.28 102.04 99.64 98.18 101.36 100.66 98.89 101.51 100.57 Ⅳ 实测值/(mg/L) 2.04±0.07 10.05±0.02 50.10±0.02 2.04±0.12 9.99±0.09 50.56±0.46 2.00±0.20 9.99±0.08 49.29±2.43 加标回收率/% 102.02 100.72 100.29 101.77 99.91 101.11 100.06 99.9 98.57 Ⅴ 实测值/(mg/L) 2.00±0.01 10.09±0.09 49.95±0.19 1.97±0.01 10.10±0.04 50.11±0.44 1.99±0.03 10.08±0.01 50.01±0.26 加标回收率/% 100.01 101.33 99.74 98.66 100.98 100.22 99.4 100.76 100.02 Ⅵ 实测值/(mg/L) 1.99±0.01 10.00±0.03 49.84±0.53 1.98±0.01 9.92±0.01 50.19±0.54 1.95±0.04 9.93±0.02 49.84±0.24 加标回收率/% 99.72 99.9 99.91 99.22 99.17 100.38 97.67 99.33 99.68 表 4 倍硫磷及其5种代谢产物的线性范围和灵敏度
物质名称 保留时间/min 最大吸收波长/nm 回归方程 相关系数 检出限/(mg/L) 定量限/(mg/L) 倍硫磷氧亚砜 2.818 238 ŷ=7 257.1x-1 339.1 0.999 8 0.2 0.6 倍硫磷氧砜 2.955 226 ŷ=12 568.0x-4 634.4 0.999 9 0.1 0.3 倍硫磷亚砜 4.109 240 ŷ=7 694.1x-1 048.0 0.999 8 0.2 0.6 倍硫磷砜 4.243 230 ŷ=11 805.0x-3 411.1 0.999 8 0.1 0.3 倍硫磷氧化物 4.853 251 ŷ=12 968.0x-2 820.6 0.999 8 0.1 0.3 倍硫磷 5.778 252 ŷ=11 964.0x-716.5 0.999 8 0.1 0.3 表 5 倍硫磷及其5种代谢产物的加标回收率和精密度
待测物 批内 批间 2.00 mg/L 10.00 mg/L 50.00 mg/L 2.00 mg/L 10.00 mg/L 50.00 mg/L Ⅰ 实测值/(mg/L) 2.01±0.02 10.05±0.13 51.10±1.04 1.78±0.03 9.34±0.13 47.58±0.51 加标回收率/% 100.74 100.53 102.2 89 93.4 95.16 RSD/% 1.00 1.29 2.04 1.94 1.39 1.07 Ⅱ 实测值/(mg/L) 1.74±0.04 9.2±0.06 50.41±1.44 1.43±0.02 9.06±0.15 48.23±1.10 加标回收率/% 87.18 92.01 100.82 71.50 90.60 96.46 RSD/% 2.30 0.65 2.86 1.47 1.69 2.28 Ⅲ 实测值/(mg/L) 2.22±0.11 10.18±0.18 46.27±1.02 2.15±0.12 10.24±0.54 48.55±2.19 加标回收率/% 111.02 101.84 92.54 107.50 102.40 97.10 RSD/% 4.95 1.77 2.20 5.61 5.29 4.50 Ⅳ 实测值/(mg/L) 2.09±0.04 10.08±0.06 49.97±1.78 1.99±0.14 8.98±0.45 50.38±1.41 加标回收率/% 104.40 100.75 99.95 99.50 89.80 100.76 RSD/% 1.91 0.60 3.56 7.19 4.96 2.80 Ⅴ 实测值/(mg/L) 2.08±0.04 10.88±0.11 51.54±5.08 2.14±0.12 9.60±0.63 47.59±2.08 加标回收率/% 103.86 108.77 103.09 107.00 96.00 95.18 RSD/% 1.92 1.01 9.86 5.67 6.52 4.37 Ⅵ 实测值/(mg/L) 1.92±0.01 10.15±0.12 49.66±3.91 1.78±0.04 8.72±0.19 49.04±2.32 加标回收率/% 95.82 101.52 99.33 89.00 87.20 98.08 RSD/% 0.52 1.18 7.87 2.12 2.21 4.73 表 6 4 ℃保存不同时间倍硫磷及其5种代谢产物的回收率
(%) 质量浓度 检测时间 Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ Ⅵ 2 mg/L 1 d 74.73±3.12 0.00±0.00 122.01±7.15 93.82±3.05 111.37±2.75 100.43±3.60 3 d 5.89±0.06 0.00±0.00 126.62±8.02 113.82±21.12 92.02±1.36 84.33±0.76 7 d 5.13±2.05 0.00±0.00 137.49±3.06 81.50±2.66 60.27±5.46 65.25±4.37 10 mg/L 1 d 74.67±15.63 0.00±0.00 118.59±3.47 98.48±3.62 106.97±5.78 95.08±2.78 3 d 14.03±0.39 0.00±0.00 88.56±2.84 51.86±1.65 75.99±0.53 80.98±0.44 7 d 20.78±0.85 0.00±0.00 116.83±1.22 57.59±1.56 50.35±0.60 74.51±2.32 50 mg/L 1 d 96.25±1.99 7.23±0.08 116.76±2.77 98.25±3.45 109.25±1.64 94.01±2.03 3 d 87.46±0.54 0.00±0.00 123.46±0.94 92.30±0.91 100.14±1.40 88.03±2.69 7 d 68.31±1.05 0.00±0.00 118.43±1.51 72.99±2.44 79.46±1.77 72.54±3.24 表 7 -40 ℃保存不同时间倍硫磷及其5种代谢产物的回收率
(%) 质量浓度 检测时间 Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ Ⅵ 2 mg/L 1 d 101.79±6.36 36.79±1.03 113.91±1.87 105.92±1.94 90.48±3.74 92.85±3.48 3 d 100.52±6.43 38.82±3.52 117.73±5.82 115.17±2.10 103.39±5.88 118.88±1.95 7 d 89.33±2.21 32.15±1.57 106.00±2.25 69.25±7.36 94.53±2.26 97.50±3.57 10 mg/L 1 d 94.23±1.02 50.89±2.33 92.01±1.40 114.78±2.26 107.96±1.49 102.82±0.42 3 d 91.76±0.81 50.26±2.47 94.31±1.84 116.97±1.06 109.57±1.62 103.01±2.27 7 d 85.82±0.46 53.15±0.83 87.41±3.07 104.58±5.75 102.90±3.80 97.14±5.91 50 mg/L 1 d 99.82±0.20 90.70±0.79 110.43±0.17 110.46±0.32 100.27±0.16 104.17±0.26 3 d 105.17±2.27 93.23±2.67 118.44±1.51 114.18±2.71 99.56±2.68 100.25±3.51 7 d 103.07±1.96 93.05±2.21 121.74±2.26 114.56±2.91 99.99±2.92 100.02±1.84 -
[1] 张友军. 农药无公害使用指南[M]. 北京: 中国农业出版社, 2003. [2] TSATSAKIS A M, MANOUSAKIS A, ANASTASAKI M, et al. Clinical and toxicological data in fenthion and omethoate acute poisoning[J]. J Environ Sci Health B, 1998, 33(6): 657-670. doi: 10.1080/03601239809373170
[3] SERRANO N, FEDRIANI J. Fenthion suicide poisoning by subcutaneous injection[J]. Intensive Care Med, 1997, 23(1): 129.
[4] NISHIO T, TOUKAIRIN Y, HOSHI T, et al. Simultaneous determination of fenthion and its metabolites in a case of fenthion self-poisoning[J]. Leg Med (Tokyo), 2023, 65: 102323. doi: 10.1016/j.legalmed.2023.102323
[5] DAR M A, HAMID B, KAUSHIK G. Temporal trends in the use and concentration of organophosphorus pesticides in Indian riverine water, toxicity, and their risk assessment[J]. Reg Stud Mar Sci, 2023: 59.
[6] 刘平, 王子怡, 赵旭东, 等. 通过式净化结合超高效液相色谱-串联质谱快速检测牛羊奶中有机磷农药残留[J]. 卫生研究, 2022, 51(3): 483-489. [7] MA C, WEI D, LIU P, et al. Pesticide residues in commonly consumed vegetables in Henan province of China in 2020[J]. Front Public Health, 2022, 10: 901485. doi: 10.3389/fpubh.2022.901485
[8] BERNARD C D. Components of a systems approach for the management of Queensland fruit fly Bactrocera tryoni(Froggatt) in a post dimethoate fenthion era[J]. Crop Protection, 2019, 116: 56-67. doi: 10.1016/j.cropro.2018.10.002
[9] HERAVIZADEH O R, KHADEM M, DEHGHANI F, et al. Determination of fenthion in urine samples using molecularly imprinted nanoparticles: modelling and optimisation by response surface methodology[J]. Int J Environ Anal Chem, 2022, 102(17): 6105-6119. doi: 10.1080/03067319.2020.1808630
[10] FAROOQ S, CHEN B, GAO F, et al. Development of molecularly imprinted polymers for fenthion detection in food and soil samples[J]. Nanomaterials(Basel), 2022, 12(13): 2129. doi: 10.3390/nano12132129
[11] GUAN M, HE H, LI R, et al. Lanthanum ions assisted non-enzymatic ratiometric fluorescence probe for monitoring fenthion residues in agro-product samples[J]. Anal Chim Acta, 2022, 1236: 340579. doi: 10.1016/j.aca.2022.340579
[12] BODUR S, BORAHAN T, ATES N, et al. Sensitive determination of acetochlor, Alachlor, metolachlor and fenthion utilizing mechanical shaking assisted dispersive liquid-liquid microextraction prior to gas chromatography-mass spectrometry[J]. Bull Environ Contam Toxicol, 2020, 105(3): 460-467. doi: 10.1007/s00128-020-02965-z
[13] 王超超, 耿发家, 李启卉. 气相色谱-串联质谱法测定豇豆中倍硫磷残留量的不确定度评定[J]. 食品安全导刊, 2021(33): 86-88. [14] 陈土明, 赵娅萍. 气相色谱法同时测定地表水中倍硫磷、地虫硫磷、对硫磷和马拉硫磷残留量[J]. 轻工科技, 2021, 37(7): 87-88. [15] 王心如. 毒理学基础[M]. 北京: 人民卫生出版社, 2013. [16] 张续, 韩林学, 邱天, 等. 固相萃取-超高效液相色谱-串联质谱法测定人尿中苯氧乙酸除草剂和有机磷、拟除虫菊酯农药代谢物[J]. 色谱, 2023, 41(3): 224-232. [17] LEE J, KIM J H. Simultaneous analysis of fenthion and its five metabolites in produce using ultra-high performance liquid chromatography-tandem mass spectrometry[J]. Molecules, 2020, 25(8): 1938.
[18] TAYLOR M J, KEENAN G A, REID K B, et al. The utility of ultra-performance liquid chromatography/electrospray ionisation time-of-flight mass spectrometry for multi-residue determination of pesticides in strawberry[J]. Rapid Commun Mass Spectrom, 2008, 22(17): 2731-2746.
[19] 刘虎威. 气相色谱方法及应用[M]. 2版. 北京: 化学工业出版社, 2007. -
期刊类型引用(1)
1. 黄顺利,赵清婷,龚志华,胡迪,范清,杨婧. 超高效液相色谱—串联质谱法测定泡制酒中7种乌头类生物碱. 疾病预防控制通报. 2022(03): 73-77 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载: